本试题 “[化学选修3:物质结构与性质]Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:①Q为元素周期表中原子半径最小的元素;②R的基态原子中电子占据三...” 主要考查您对离子方程式
晶胞
分子晶体
电负性
物质性质的研究
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子方程式
- 晶胞
- 分子晶体
- 电负性
- 物质性质的研究
用实际参加反应的离子符号表示离子反应的式子。
离子方程式书写规则:
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
离子方程式书写及正误的判断方法:
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“
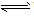 ”及状态符号“↑”和“↓”运用是否正确。
”及状态符号“↑”和“↓”运用是否正确。 强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“
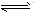 ”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。 ⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO2、SO2、H2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
⑩判断电解质在写成离子形式时阴阳离子个数比是否合理。
如Ba(OH)2溶液和稀H2SO4反应的离子方程式往往错误写成:
 ,正确为:
,正确为: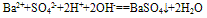
书写与量有关的离子方程式:
基本方法是:把物质的量少的物质的系数定为1,其他物质按最大量消耗。
1.因滴加顺序不同造成连续反应
- HCl与Na2CO3
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- HCl与NaAlO2
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- AlCl3与NaOH
向AlCl3溶液中滴入NaOH溶液至过量,其离子反应分步写 (1)Al3++3OH-==Al(OH)3↓ (2)Al(OH)3+OH-==AlO2-+2H2O
若向NaOH溶液中加入少量AlCl3溶液,其离子反应一步完成 Al3++4OH-==AlO2-+2H2O
若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为: Al3++3OH-==Al(OH)3↓
- AgNO3与NH3·H2O
向AgNO3溶液中滴入稀NH3·H2O至过量,其离子反应分步写(1) Ag++NH3·H2O==AgOH↓+NH4+ (2)AgOH+2NH3·H2O==Ag(NH3)2++OH-+2H2O
若向NH3·H2O溶液中加入少量AgNO3,其离子反应一步完成 Ag++3NH3·H2O==Ag(NH3)2++OH-+NH4++2H2O
若向足量AgNO3溶液中滴入少量NH3·H2O,其离子方程式为:Ag++NH3·H2O==AgOH↓+NH4+
- CO2与NaOH
向NaOH溶液中通人CO2气体至过量,其离子反应分步写 (1)2OH-+CO2==CO32-+H2O (2)CO32-+CO2+H2O==2HCO3-
若向足量NaOH溶液中通人少量CO2气体,其离子方程式为: 2OH-+CO2==CO32-+H2O
若向NaOH溶液中通人过量CO2气体,其离子反应一步完成 OH-+CO2==HCO3-
2.过量型:
向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 OH-+Ca2++HCO3-==H2O+CaCO3↓
向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-
Fe与HNO3 :铁过量时:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O
铁不足时:3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
3.定量型:
因还原性I->Fe2+>Br-,所以在FeI2或者FeBr2中通入一定量的Cl2,发生不同的离子反应,依次为:
(1)2I-+Cl2==2Cl-+I2(2)2Fe2++Cl2==2Fe3++2Cl-(3)2Br-+Cl2==2Cl-+Br2
4.目标型
向明矾溶液逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全 Al3++SO42-+Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
向明矾溶液逐滴滴加Ba(OH)2溶液至铝离子刚好沉淀完全 Al3+SO42-+Ba2++3OH-==Al(OH)3↓+2BaSO4↓
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有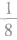 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有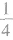 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有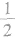 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×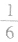 +2×
+2×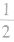 =3,硼原子个数为6。
=3,硼原子个数为6。 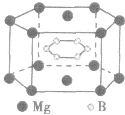
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 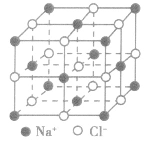 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 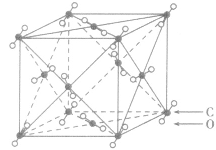 |
| 金刚石晶体 |  |
| SiO2晶体 | 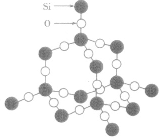 |
| 石墨晶体 (混合晶体) | 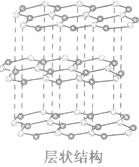 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
电负性:
(1)键合电子、电负性的定义
元素相互化合时,原子中用于形成化学键的电子称为键合电子。电负性用来描述不同元素的原子对键合电子吸引力的大小。
(2)电负性的意义:电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0作为相对标准。
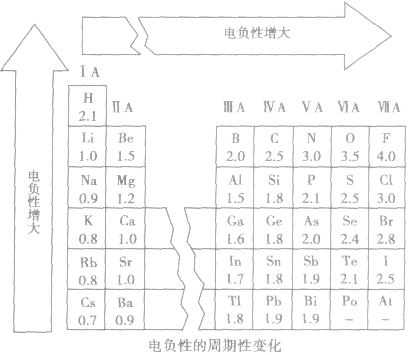
(4)电负性的变化规律
①随原子序数的递增,元素的电负性呈周期性变化。
②同周期,从左到右,元素的电负性逐渐变大。
③同主族,从上到下,元素的电负性逐渐变小。
电负性的应用:
①判断元素的金属性和非金属性的强弱
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②判断元素化合价的正负
利用电负性可以判断化合物中元素化合价的正负:电负性大的元素易呈现负价,电负性小的元素易呈现正价。
③判断化学键的类型
一般认为,如果成键原子所属元素的电负性差值大于 1.7,它们之间通常形成离子键;如果成键原子所属元素的电负性差值小于1.7,它们之间通常形成共价键。
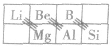
④解释“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如右图所示)的有些性质是相似的,被称为“对角线规则”。例如:硼和硅的含氧酸盐都能形成玻璃且互熔,含氧酸都是弱酸等。
研究对象:
物质的物理性质、化学性质物质性质。
研究方法:
观察与问题、假设与预测、实验与事实、解释与结论、表达与交流、扩展与迁移。
与“[化学选修3:物质结构与性质]Q、R、X、Y、Z为周期表前四周期...”考查相似的试题有:
- 下列离子方程式错误的是( )A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑B.盐酸与氢氧化钡溶液:H++OH-=H2OC.碳酸钙与稀硝酸...
- 离子方程式CO32-+ 2H+="=" H2O+ CO2↑中的CO32-代表的物质可以是 ( )A.CaCO3B.Na2CO3C.BaCO3D.NaHCO3
- 表示下列反应的离子方程式,正确的是[ ]A.碱性高锰酸钾溶液与草酸氢钾反应:2MnO4-+HC2O4-+2H2O=2MnO42-+2CO32-+5H+B.用稀...
- 下列离子方程式书写不正确的是[ ]A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-=Al(OH)3↓+AlO2-+2H...
- 请写出下列离子方程式:(1)铁片插入硫酸铜溶液中______(2)氢氧化钠溶液与稀盐酸混合______.
- (10分)向含0.2molAl3+的明矾溶液中逐渐加入2mol/LBa(OH)2溶液时,测得产生沉淀质量m(g)和逐渐加的2mol/LBa(OH)2溶液...
- 下列解释事实的方程式不正确的是( )A.测0.1mol/L氨水的pH为11:NH3·H2ONH4++OH-B.将Na块放入水中,产生气体:2Na+2H2O=2N...
- 下列离子方程式正确的是[ ]A.向盐酸中滴加氨水:H++OH-=H2OB.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2OC.铜溶于稀硝酸:3...
- 写出下列反应的离子方程式:(1)碳酸钙和盐酸反应(2)氢氧化钠溶液和醋酸(CH3COOH)溶液反应(3)锌和硫酸铜溶液反应(4)氢氧化钡溶...
- 下列说法不正确的是[ ]A.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐...