本试题 “把煤作为燃料可通过下列两种途径:途径I: C(s)+O2(g) === CO2(g)途径II:先制水煤气:C(s) + H2O(g) === CO(g) + H2(g)燃烧水煤气:2CO(g) + O2(g) === 2CO...” 主要考查您对吸热反应、放热反应
盖斯定律
燃烧热
煤的综合利用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 盖斯定律
- 燃烧热
- 煤的综合利用
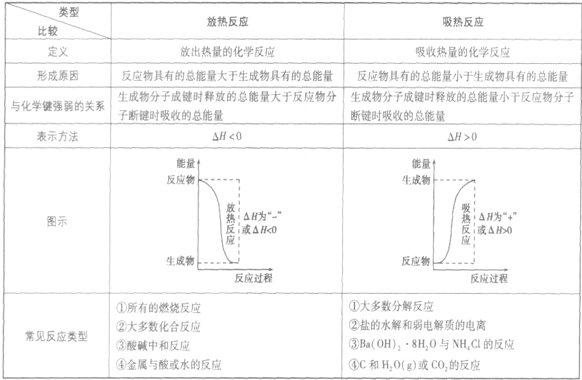
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。

根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


燃烧热:
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如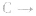
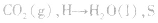
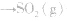 等
等
(4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
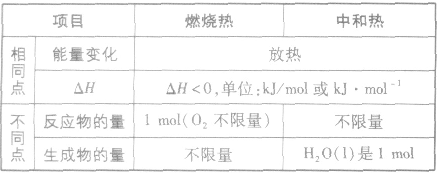
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
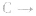
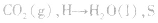
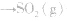 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
煤:
①煤的汽化:
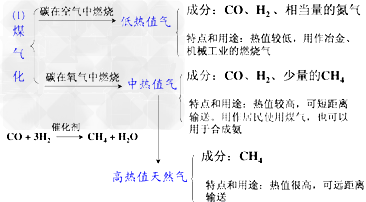
②煤的干馏:把煤隔绝空气加强热使它分解的过程,叫做煤的干馏

③煤的液化:煤的液化分直接液化和间接液化两种。

①煤的汽化:

②煤的干馏:把煤隔绝空气加强热使它分解的过程,叫做煤的干馏

③煤的液化:煤的液化分直接液化和间接液化两种。

发现相似题
与“把煤作为燃料可通过下列两种途径:途径I: C(s)+O2(g) === C...”考查相似的试题有:
- 下列说法中正确的是( )A.凡是物质的化学变化都伴随着能量的变化B.凡是物质的化学变化就一定只伴随着化学能与热能的转化C...
- 下列说法不正确的是[ ]A.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小B.NH4Cl与Ca(OH)2固体反应是放热...
- 北京奥运会“祥云”火炬燃料是阿烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。(1)丙烷脱氢可得丙烯已知C3H8(g)=CH4(g)+HC=CH...
- 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化...
- 25℃、101kPa时,下列哪个反应放出的热量能表示乙炔的燃烧热(单位:kJ/mol)[ ]A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)B.C2H2(g...
- 下列说法中不正确的是A.煤、石油、天然气均为化石能源B.化石燃料在燃烧过程中能产生污染环境的SO2等有害气体C.直接燃烧煤...
- 下列热化学方程式中,△H能正确表示物质的燃烧热的是A.C(s) +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/molB.CO(g) +1/2O2(g) ==CO...
- 汽车内燃机工作时产生的电火花和高温会引起反应:N2(g)+O2(g)=2NO(g),导致汽车尾气中的NO和NO2对大气造成污染。(1)在不同...
- 我国要求在全国范围内形成全民节能减排氛围。下列有关做法中不符合这一要求的是( )A.将煤液化、气化,提高燃料的燃烧效率B....
- 已知:(1)Zn(s)+O2(g)=== ZnO(s),ΔH=" -348.3" kJ·mol-1,(2)2Ag(s)+O2(g)=== Ag2O(s),ΔH=" -31.0" kJ·mol-1,则...