钠的基本性质:
钠元素的原子序数等于11,在周期表中位于第三周期,第ⅠA族。钠的原子结构示意图为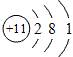 ,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
钠的物理性质:
钠单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
概括为:银白软轻低,热电良导体。
钠的化学性质:
钠的原子结构示意图为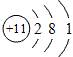 。
。
①与非金属单质的反应
A. 与氧气反应
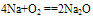 (白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)
(白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)
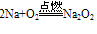 (淡黄色固体,较稳定)
(淡黄色固体,较稳定)
B. 与硫反应
2Na + S ==Na2S (研磨时发生爆炸)
C. 与氯气反应
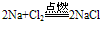
②与水反应
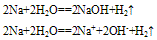
| 主要实验现象 |
对实验现象的分析 |
| 浮在水面上 |
密度比水小 |
| 熔化成闪亮的小球 |
反应放热,且钠的熔点低 |
| 迅速游动 |
反应产生气体(H2) |
| 嘶嘶作响 |
反应剧烈 |
| 溶液呈红色 |
反应生成NaOH,遇酚酞变红 |
③与盐溶液反应
钠与盐溶液反应,先考虑钠与水反应生成氢氧化钠,在考虑氢氧化钠是否与盐反应。
A. 投入NaCl溶液中,只有氢气放出。2Na+2H2O==2NaOH+H2↑
B. 投入饱和NaCl溶液中,有氢气放出,还有NaCl晶体析出(温度不变)。
C. 投入NH4Cl溶液中,有H2和NH3逸出。2Na+2NH4Cl==2NaCl+2NH3↑+H2↑
D. 投入CuSO4溶液中,有气体放出和蓝色沉淀生成。
2Na+2H2O+CuSO4==Na2SO4+Cu(OH)2↓+H2↑
如何正确取用钠?
钠具有很活泼的化学性质,易与很多物质反应,所以在取用钠时一定要注意,千万不能直接用手去拿,以免手被腐蚀,实验剩余的钠屑,绝对不可以随意丢弃,而应放回到原瓶中。
正确做法:用镊子取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色。实验中剩余的钠必须放回原瓶。
钠露置在空气中的一系列变化:
Na→Na2O→NaOH→Na2CO3→Na2CO3·10H2O→Na2CO3
钠的保存、制取及用途 :
①保存:由于金属钠的化学性质非常活泼,易与空气中的氧气、水蒸气反应,所以钠要保存在煤油中。
②在实验室中钠块的取用:用镊子从试剂瓶中取出钠块,用滤纸吸净表面上的煤油,在玻璃片上用小刀切去表面的氧化层,再切下一小粒备用,余下的钠全部放回试剂瓶中。
③制取:
④用途:
A. 工业上用Na作还原剂,用与冶炼金属,如4Na+TiCl4 Ti+4NaCl
Ti+4NaCl
B. Na-K合金(液态)用作原子反应堆的导热剂。
C. 在电光源上,用钠制造高压钠灯。
焰色反应:
焰色反应是化学上用来测试某种金属是否存在在化合物的方法。其原理是每种元素都有其特别的光谱,显示出不同的颜色。
焰色反应的操作:
先准备一支铂丝,钴蓝玻璃及盐或其溶液。
把铂丝浸在浓盐酸中以清除先前余下的物质,再把铂丝放在酒精灯焰(蓝色火焰)中直至没有颜色的变化。
用蒸馏水或去离子水或纯水冲洗铂丝。
用铂丝接触盐或溶液,通过酒精灯焰(蓝色火焰)中加热。
当钠离子存在于所测试的溶液中,用钴蓝玻璃过滤钠离子的焰色。
最后将观察焰色。钠的焰色为明亮的金黄色火焰。
各种元素的颜色:
| 元素符号 |
离子元素 |
名称 |
焰色 |
| Ba |
Ba2+ |
钡 |
黄绿 |
| Ca |
Ca2+ |
钙 |
砖红 |
| Cs |
Cs+ |
铯 |
浅紫 |
| Na |
Na+ |
钠 |
黄 |
| Zn |
Zn2+ |
锌 |
蓝绿 |
| Fe(III) |
Fe3+ |
铁(III) |
金黄 |
| K |
K+ |
钾 |
浅紫(透过蓝色钴玻璃) |
| Li |
Li+ |
锂 |
深红 |
碱金属元素的性质:
1.氧化产物的特殊性。碱金属在空气中燃烧,只有Li氧化生成Li2O;其余的生成过氧化物(如Na2O2)或更复杂的氧化物(如KO2)。
2.碱金属单质密度都较小,其中锂的密度是所有金属中最小的。
3.碱金属单质熔点都较低,只有Li的熔点高于100℃。
4.钾、钠在常温下为固态,但钾钠合金在常温下为液态,可作为原子反应堆的导热剂。
5.碱金属单质通常保存在煤油中,但因锂的密度小于煤油而只能保存在液体石蜡中或封存在固体石蜡中。
6.一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
7.试剂瓶中的药品取出后,一般不能放回原瓶,但ⅠA族金属Na、K等除外。
8.一般活泼金属能从盐中置换出不活泼金属,但非常活泼的金属Na、K等除外。
9.Fr是放射性元素,所以在自然界中不存在。
氧化钠的基本性质:
白色固体,碱性氧化物,不稳定
(1)与水反应:Na2O+H2O==2NaOH
(2)与CO2反应:Na2O+CO2==Na2CO3
(3)与HCl反应:Na2O+2HCl==2NaCl+H2O
氧化钠与过氧化钠的比较:
| 物质 |
氧化钠 |
过氧化钠 |
| 色态 |
白色固体 |
淡黄色固体 |
| 类别 |
碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 |
仅含离子键 |
离子键和非极性键 |
| 电子式 |
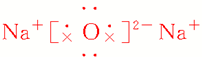 |
 |
| 生成条件 |
常温 |
点燃或加热 |
| 氧的化合价 |
-2 |
-1 |
| 阴阳离子个数比 |
1:2 |
1:2 |
| 稳定性 |
不稳定 |
稳定 |
| 转化关系 |
2Na2O+O2=2Na2O2 |
| 用途 |
用于制取少量过氧化钠 |
供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 |
2Na2O+2H2O=2NaOH |
2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 |
Na2O+CO2=NaCO3 |
2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 |
Na2O+2HCl=2NaCl+H2O |
2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 |
隔绝空气、密封保存 |
隔绝空气、远离易燃物、密封保存 |
过氧化钠(Na2O2)的基本性质:
淡黄色固体,较稳定,可用作供氧剂、漂白剂
(1)与水反应:2Na2O2+2H2O==4NaOH+O2↑
(2)与CO2反应:2Na2O2+2CO2==2Na2CO3+ O2
(3)与HCl反应:2Na2O2+4HCl==4NaCl+2H2O+ O2↑
过氧化钠的特性及计算:
1.过氧化钠的强氧化性

2.Na2O2与CO2、H2O(g)反应的重要关系
(1)气体体积差的关系
2Na2O2+2CO2===2Na2CO3+O2 气体体积差 ①
2 1 ΔV=1
2Na2O2+2H2O(g)===4NaOH+O2 气体体积差 ②
2 1 ΔV=1
由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,即为生成氧气的量。
(2)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
(3)电子转移关系
当Na2O2与CO2或H2O反应时,每产生1molO2就转移2mol电子。
(4)固体质量变化关系
①足量过氧化钠与水、CO2反应的计算
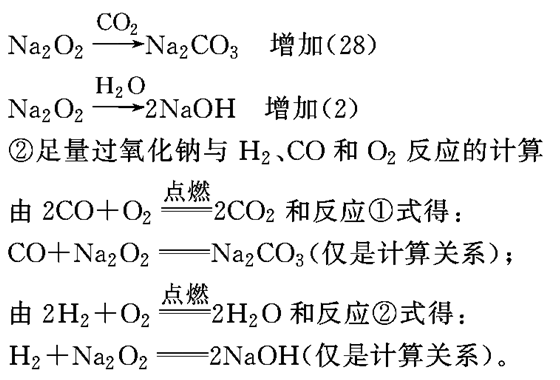
所以,有ag通式符合(CO)m(H2)n(m=0,1,2,3…,n=0,1,2,3…)的物质(包括纯净物和混合物)在氧气中燃烧,将其通过足量过氧化钠,反应完毕后,固体增重ag。
氧化钠与过氧化钠的比较:
| 物质 |
氧化钠 |
过氧化钠 |
| 色态 |
白色固体 |
淡黄色固体 |
| 类别 |
碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 |
仅含离子键 |
离子键和非极性键 |
| 电子式 |
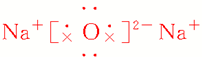 |
 |
| 生成条件 |
常温 |
点燃或加热 |
| 氧的化合价 |
-2 |
-1 |
| 阴阳离子个数比 |
1:2 |
1:2 |
| 稳定性 |
不稳定 |
稳定 |
| 转化关系 |
2Na2O+O2=2Na2O2 |
| 用途 |
用于制取少量过氧化钠 |
供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 |
2Na2O+2H2O=2NaOH |
2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 |
Na2O+CO2=NaCO3 |
2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 |
Na2O+2HCl=2NaCl+H2O |
2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 |
隔绝空气、密封保存 |
隔绝空气、远离易燃物、密封保存 |
特别提醒:
(1)用脱脂棉包裹住过氧化钠,滴加少量水时脱脂棉可以燃烧,不仅可以说明Na2O2与H2O反应生成O2,还可以说明该反应放热。
(2)Na2O2与H2O反应时H2O既不是氧化剂也不是还原剂。
方法技巧:Na2O与Na2O2的结构与性质
(1)Na2O中只含离子键,Na2O2中既含离子键,又含非极性键。
(2)等物质的量的Na2O与Na2O2分别于等量且足量的H2O反应,所得溶液的成分浓度相同
其他的常见钠盐:
(1)氯化钠:与硝酸银反应:Cl-+Ag+==AgCl↓
工业上--制碱、生活中--食用、医用上--生理盐水氯化钠(NaCl)
用途:可用于食品调味和腌鱼肉蔬菜;制造氯气、氢气、盐酸、氢氧化钠、氯酸盐、次氯酸盐、漂白粉、金属钠,以及供盐析肥皂和鞣制皮革等。经高度精制的NaCl可用来制造生理盐水等。广泛用于临订治疗和生理实验,如失钠、失水、失血等情况。自然界中有盐矿,大量存在于海水和盐湖中。性质:式量58.44。食盐的主要成份。常见的有白色立方晶体或细小的结晶粉末。密度2.165克/厘米3。熔点801℃。沸点1413℃。味咸。溶于水,显中性。由浓缩海水结晶而制得,也可从天然的盐湖或盐井水制取。
(2)硫化钠:
①硫化钠遇酸反应,产生硫化氢。水溶液呈强碱性,故又称硫化碱。溶于硫黄生成多硫化钠。工业品因含杂质常为粉红、棕红色、土黄色块。有腐蚀性,有毒。在空气中易氧化生成硫代硫酸钠。
②硫化钠吸湿性很强,在100g水中的溶解度为15.4g(10℃),57.3g(90℃)。微溶于乙醇,不溶于乙醚。
③贮存方法:应放置通风、干燥处或石棉棚下。应防止雨淋和受潮。硫化碱潮解性大,又易氧化,容器必须密封。
(3)硫代硫酸钠:
①硫代硫酸钠,又名大苏打、海波,白色粉末,易溶于水。
②常用作照相定影剂
③是碘量法常用的还原剂
④与酸很容易歧化,生成气体和沉淀:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
钠的热点化合物:
叠氮酸钠(NaN3),类似于强碱弱酸盐。
氮化钠(Na3N),类盐,水解生成氢氧化钠和氨气,类似氮化镁、氮化钙、碳化钙等。
过硫化钠(Na2S2),具有类似过氧化钠的结构和化学性质。
高铁酸钠(Na2FeO4),具有强氧化性,还原产物为+3价铁的化合物。