本试题 “下列实验与对应的结论不符合的是( )A.能证明非金属性Cl>C>SiB.能组成Zn、Cu原电池C.颜色深浅不同说明反应2NO2⇌N2O4,△H<0D.白色沉淀为BaSO4” 主要考查您对元素周期表
影响化学平衡的因素
原电池原理的探究实验
化学科学探究
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 元素周期表
- 影响化学平衡的因素
- 原电池原理的探究实验
- 化学科学探究
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
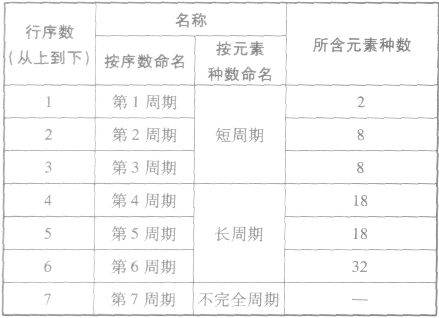
(2)族
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
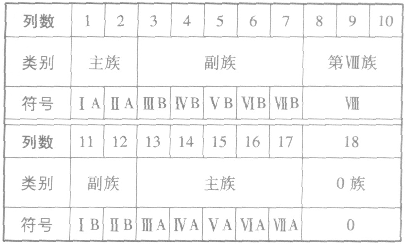
(3)元素周期表中主族元素金属性和非金属性的递变
影响化学平衡的因素:
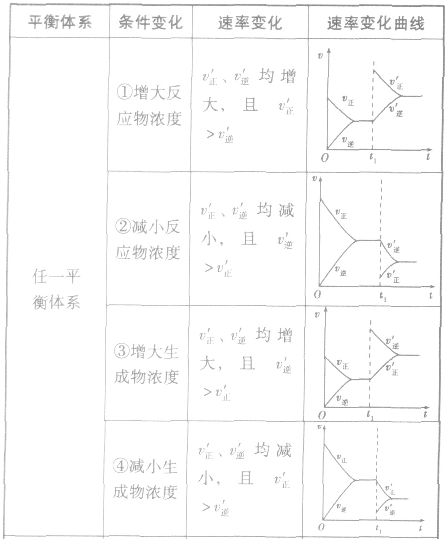
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应 来说,加压,
来说,加压, 增大、
增大、 增大,
增大, 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,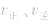 均减小,
均减小,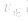 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
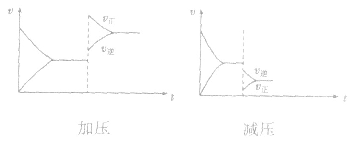
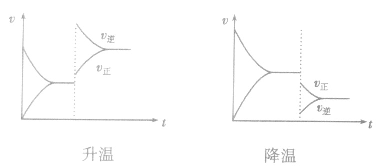
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于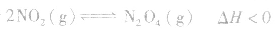 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
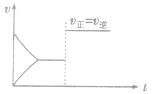
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为
稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
2.恒温恒压时
充入稀有气体 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。
3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
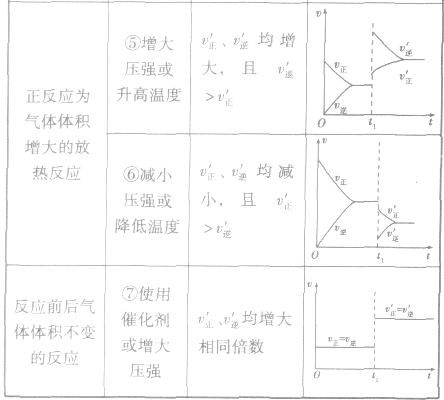
2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。

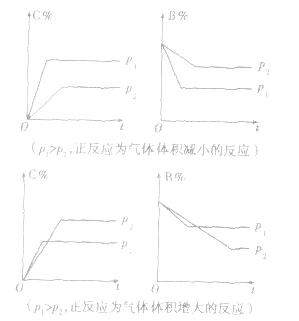
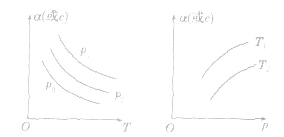
3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:
小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g) bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:

(2)若反应物不止一种时,如aA(g)+bB(g) cC(g)+dD(g):
cC(g)+dD(g):
a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如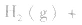
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,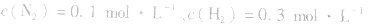 ,
,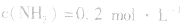 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让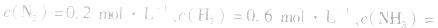
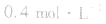 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如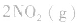
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物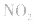 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应
 来说,加压,
来说,加压,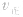 增大、
增大、 增大,
增大,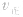 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,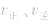 均减小,
均减小,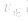 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于
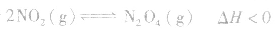 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为

稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。 2.恒温恒压时
充入稀有气体
 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了
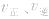 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。

2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。


3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:

小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g)
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
(2)若反应物不止一种时,如aA(g)+bB(g)
 cC(g)+dD(g):
cC(g)+dD(g): a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如
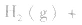
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。 4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,
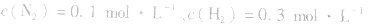 ,
,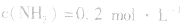 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让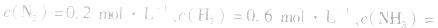
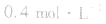 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如
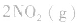
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物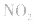 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小原电池原理的探究实验:
(1)通过设计实验的方式探究原电池的形成条件:①负极为较活泼金属;正极为较不活泼金属、石墨等②电极需要插入电解质溶液中③必需形成闭合回路
(2)工作原理:负极发生氧化反应;正极发生还原反应;电子流向:负极 正极
正极
探究过程:
(1)提出问题:化学反应伴随有能量的变化,化学能能否转变为电能呢?哪些反应能将化学能转变为电能?化学能是怎样转化为电能的呢?化学能转化为电能的基本原理是什么?
思考结果:电流形成原因:电子的定向移动(负极失电子,化合价升高,正极得电子,化合价降低)
(2)猜想与假设:原电池构成须有两个电极、导线、电解质溶液,氧化还原反应与电极和导线之间须构成闭合回路。
思考结果:电子由负极流向正极,电流由正极流向负极
(3)制定计划:用Zn片、Cu片、稀H2SO4和导线来做实验探究原电池的工作原理,具体步骤见进行实验一栏。
思考结果:1.连接导线前,锌片上有气泡,铜片上无气泡;连接导线后,锌片上气泡减少,铜片上出现比较多的气泡。 2.电流计的指针有一些偏转。
(4)进行实验
实验1.将Zn片插入稀H2SO4中,观察现象并解释原因。
实验2.将Cu片插入稀H2SO4中,观察现象并解释原因。
实验3.取锌片和铜片同时插入装有稀H2SO4的烧杯中,观察现象。
实验4.用导线将插入稀H2SO4中的锌片和铜片连接起来,观察现象。
思考结果:4个实验中实验1有气泡产生,实验2没有明显现象,实验3中铜片上没有明显现象,实验4中大量气泡在铜片上产生,锌片逐渐溶解。
(5)收集证据:在导线间接入一个电流计来验证猜想与假设是否正确。
思考结果:1.形成了以铜,锌为电极,稀硫酸为电解液的原电池。 2.锌是电子流出方,为负极;铜片为正极。
(6)解释与结论:可以从电流计上看到,电流的方向是由铜片流向锌片。电子带负电荷,其流向与电流流向相反,因此,电子的流向是由锌片经导线流向铜片的。把原电池失去电子一极叫负极,得到电子一极叫正极。电子流向是通过原电池的负极流向正极,较活泼金属失去电子,发生氧化反应,氧化剂从正极得到电子,发生还原反应。这两个反应均是在电极上进行的,我们称之为“电极反应”。
思考结果:原电池的构成条件:第一,必须有电极。电极材料可以是活泼性不同的金属或者是金属与非金属构成。较活泼的金属为负极,较不活泼的金属或非金属为正极。第二,必须有电解质溶液,第三,要有导线,形成闭合回路。
(7)反思与评价:原电池形成的条件:1.形成闭合回路;2.溶液中有自由移动的离子;3.不同活泼性的电极,能发生自发的氧化还原反应学习原电池的工作原理和构成条件,其有利于生活,比如利用原电池原理来制备各种各样的电池。还能利用所学知识来解释生活中常见的一些现象,例如钢铁的腐蚀。
(1)通过设计实验的方式探究原电池的形成条件:①负极为较活泼金属;正极为较不活泼金属、石墨等②电极需要插入电解质溶液中③必需形成闭合回路
(2)工作原理:负极发生氧化反应;正极发生还原反应;电子流向:负极
 正极
正极 探究过程:
(1)提出问题:化学反应伴随有能量的变化,化学能能否转变为电能呢?哪些反应能将化学能转变为电能?化学能是怎样转化为电能的呢?化学能转化为电能的基本原理是什么?
思考结果:电流形成原因:电子的定向移动(负极失电子,化合价升高,正极得电子,化合价降低)
(2)猜想与假设:原电池构成须有两个电极、导线、电解质溶液,氧化还原反应与电极和导线之间须构成闭合回路。
思考结果:电子由负极流向正极,电流由正极流向负极
(3)制定计划:用Zn片、Cu片、稀H2SO4和导线来做实验探究原电池的工作原理,具体步骤见进行实验一栏。
思考结果:1.连接导线前,锌片上有气泡,铜片上无气泡;连接导线后,锌片上气泡减少,铜片上出现比较多的气泡。 2.电流计的指针有一些偏转。
(4)进行实验
实验1.将Zn片插入稀H2SO4中,观察现象并解释原因。
实验2.将Cu片插入稀H2SO4中,观察现象并解释原因。
实验3.取锌片和铜片同时插入装有稀H2SO4的烧杯中,观察现象。
实验4.用导线将插入稀H2SO4中的锌片和铜片连接起来,观察现象。
思考结果:4个实验中实验1有气泡产生,实验2没有明显现象,实验3中铜片上没有明显现象,实验4中大量气泡在铜片上产生,锌片逐渐溶解。
(5)收集证据:在导线间接入一个电流计来验证猜想与假设是否正确。
思考结果:1.形成了以铜,锌为电极,稀硫酸为电解液的原电池。 2.锌是电子流出方,为负极;铜片为正极。
(6)解释与结论:可以从电流计上看到,电流的方向是由铜片流向锌片。电子带负电荷,其流向与电流流向相反,因此,电子的流向是由锌片经导线流向铜片的。把原电池失去电子一极叫负极,得到电子一极叫正极。电子流向是通过原电池的负极流向正极,较活泼金属失去电子,发生氧化反应,氧化剂从正极得到电子,发生还原反应。这两个反应均是在电极上进行的,我们称之为“电极反应”。
思考结果:原电池的构成条件:第一,必须有电极。电极材料可以是活泼性不同的金属或者是金属与非金属构成。较活泼的金属为负极,较不活泼的金属或非金属为正极。第二,必须有电解质溶液,第三,要有导线,形成闭合回路。
(7)反思与评价:原电池形成的条件:1.形成闭合回路;2.溶液中有自由移动的离子;3.不同活泼性的电极,能发生自发的氧化还原反应学习原电池的工作原理和构成条件,其有利于生活,比如利用原电池原理来制备各种各样的电池。还能利用所学知识来解释生活中常见的一些现象,例如钢铁的腐蚀。
化学科学探究:
四个环节:查阅资料、提出假设、实验探究、结论分析
提出问题→猜想假设→制定计划→进行实验→收集证据→解释与结论→反思与评价 →表达与交流
四个环节:查阅资料、提出假设、实验探究、结论分析
提出问题→猜想假设→制定计划→进行实验→收集证据→解释与结论→反思与评价 →表达与交流
发现相似题
与“下列实验与对应的结论不符合的是( )A.能证明非金属性Cl>C...”考查相似的试题有:
- 在元素周期表中最容易找到半导体材料的合理位置是( )A.金属元素和非金属元素交界处B.过渡元素区C.周期表右上角D.周期表...
- 有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子...
- 已知反应A2(g)+2B(s)A2B2(g) △H
- 下列图示与对应的叙述相符的是 ( ) 图1 图2 图3 图4A.图1表示可逆反应“2X(g)Y(g)△H
- 下列不能说明反应P(g)+Q(g)R(g)+S(s)在恒温下已达到平衡的是( )A.反应容器内的压强不随时间改变B.反应容器内P.Q...
- 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵...
- 在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L求:(...
- (8分)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图,⑴① 该反应的化学方程式是____________...
- 一个容积固定密闭容器中进行反应:N2+ 3H2 2NH3,一定达到平衡状态的是( )①1个N≡N键断裂的同时,有3个H — H键形成;②1个N≡N...
- 能证明碳酸比硅酸酸性强的实验事实是( )A.CO2是气体,SiO2是固体B.高温下能发生反应:Na2CO3+SiO2 高温 . Na2SiO3+CO2↑C...