本试题 “短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;...” 主要考查您对原子核外电子的排布
无机分子的立体结构
晶胞
热化学方程式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子核外电子的排布
- 无机分子的立体结构
- 晶胞
- 热化学方程式
原子核外电子的排布:
在多电子原子中,由于各电子所具有的能量不同,因而分布在离核远近不同的区域内做高速运动。能量低的电子在离核近的区域内运动,能量高的电子在离核较远的区域内运动。
电子层:
电子层在含有多个电子的原子里,电子分别存能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5.6,7或K、L、 M、N、O、P、Q来表示从内到外的电子层 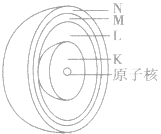

原子结构与元素的性质:
原子的核外电子排布对元素的化学性质有着非常重要的影响。元素的化学性质主要取决于原子的核外最外层电子数。
1.元素的金属性、非金属性(得失电子能力)与最外层电子数的关系
(1)稀有气体元素原子最外层电子数为8(He为 2),已达稳定结构,既不易失电子也小易得电子,所以化学性质不活泼。
(2)金属元素原子最外层电子数一般小于4,较易失去电子而达到稳定结构,其单质表现还原性。
(3)非金属元素原子最外层电子数一般大于或等于4,较易获得电子而达到稳定结构,其单质多表现氧化性。
2.元素的化合价与原子最外层电子数的关系
元素显正价还是显负价及其数值大小与原子的最外层电子数密切相关。其一般规律可归纳如下表: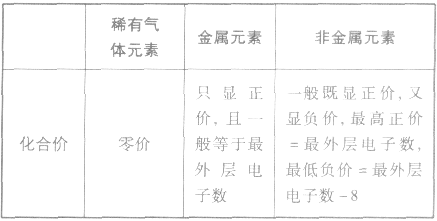
核外电子排布的一般规律:
(1)原子核外各电子层最多容纳2n2个电子.
(2)原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
(3)次外层电子数目不超过18个(K层为次外层时不超过2个,L层为次外层时不超过8个)。倒数第三层电子数目不超过32个。
(4)核外电子分层排布,电子总是优先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里,即最先排K层,当K层排满后,冉排L层等。原子核外电子排布不是孤立的,而是相互联系的。层数相同而位置不同的电子层中最多容纳的电子数小一定相同,如N层为最外层时,最多只能排8个电子;N层为次外层时,最多只能排18个电子而不是32个电子(2×42=32)。
分子中原子的空间关系是分子表现出不同的空间构型。
用价层电子对互斥理论确定分子或离子的VSEPR模型和立体构型的方法:
首先计算分子或离子中的中心原子的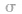 键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
1.价层电子对数的确定方法
(1) 键电子对数:由分子式确定,中心原子形成的
键电子对数:由分子式确定,中心原子形成的 键的数目就是
键的数目就是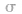 键电子对数。如
键电子对数。如 分子中的中心原子
分子中的中心原子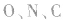 分别有2、3、4对
分别有2、3、4对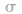 键电子对。
键电子对。
(2)孤电子对数
①分子中的中心原子上的孤电子对数
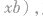 式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
以 为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则
为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则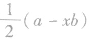 分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
②对于阳离子,a为中心原子的价电子数减去离子的电荷数;对于阴离子,a为中心原子的价电子数加上离子的电荷数(绝对值)。x和b的计算方法及计算公式[中心原子上的孤电子对数= ]均不变。
]均不变。
2.确定分子(或离子)的VSEPR模型
根据价层电子对数和价层电子对的相互排斥,可得出分子或离子的VSEPR模型,其关系如下表。 
3.确定分子(或离子)的立体构型略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型,如上表。
(1)分子或离子中的价层电子对数分别为2、3、4,则其VSEPR模型分别为直线形、平面三角形、正四面体形或四面体形。如果价层电子对数为5,则为三角双锥形;如果为6,则为正八面体形或八面体形。
(2)如果中心原子的孤电子对数为0,则VSEPR模型(及名称)和分子或离子的立体构型(及名称)是一致的;若孤电子对数不为0,则二者不一致。
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有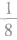 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有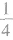 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有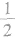 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×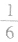 +2×
+2×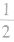 =3,硼原子个数为6。
=3,硼原子个数为6。 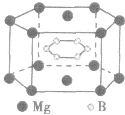
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
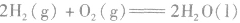 :
: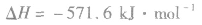 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
与“短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E...”考查相似的试题有:
- A、B、C、D、E、F、G都是由短周期元素构成的粒子,它们都有10个电子,结构特点如下表:粒子代号ABCDEFG原子核个数单核单核双...
- X、Y、Z、W为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子数比X的原子数多5,Z原子的最外层电子数比Y多3,...
- 短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B...
- 某非金属元素气态氢化物分子中的氢原子个数与该元素最高价氧化物分子中氧原子的个数之比为2:1,其氢化物与最高价氧化物相对...
- ((9分) (1)在配合物离子(FeSCN)2+中,提供空轨道接受孤对电子的微粒是 。(2)根据VSEPR模型,H3O+的分子立体结构为 ,B...
- 在以下的分子或离子中,空间结构的几何形状不是三角锥形的是( ) A.NF3 B.CH3- C.BF3 D.H3O+
- 我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素 (H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定...
- (三选一)【化学-物质结构与性质】乙炔是有机合成工业的一种原料。工业上曾用与水反应生成乙炔。(1)中互为等电子体,的电子...
- 下列有关热化学方程式书写及对应表述均正确的是( ) A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出...
- 下列用来表示物质变化时的化学用语中,正确的是[ ]A.氢硫酸溶液显酸性的主要原因:H2S2H++ S2–B.用稀氨水吸收H2S:NH3·H2O ...