本试题 “某同学仿照喷泉实验的原理在化学实验室里做了一个“喷烟实验”。如图所示,在甲、乙两个烧瓶中分别 装入A、B两种无色气体,在胶头滴管中盛含酚酞的NaOH溶液,实...” 主要考查您对二氧化硫
一氧化氮
氨气
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硫
- 一氧化氮
- 氨气
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液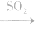 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


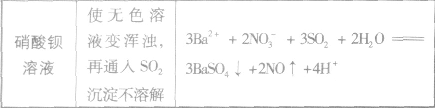
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表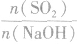 ,如下数轴所示:
,如下数轴所示: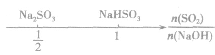
分析数轴可得:
(1)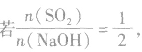 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)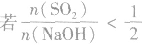 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)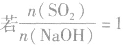 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)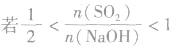 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)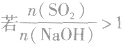 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
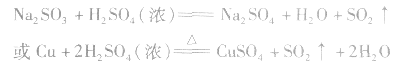
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

氮元素有+1、+2、+3、+4、+5五种正价,五种正价对应六种氧化物N2O(俗称“笑气”,具有麻醉作用)、 NO、N2O4(暗蓝色气体)、NO2、N2O4、N2O5(白色固体)。其中N2O3和N2O5分别是HNO2和HNO3的酸酐,它们都是空气污染物,空气中的NO2是造成光化学污染的主要因素。另外,在思考某些问题时,要注意:2NO2
 N2O4。对气体体积及平均相对分子质量的影响:
N2O4。对气体体积及平均相对分子质量的影响:一氧化氮的物理性质和化学性质:
(1)物理性质:无色、不溶于水、有毒的气体,密度比空气稍重。
(2)化学性质:
①极易被空气中的O2氧化: 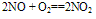
②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性。
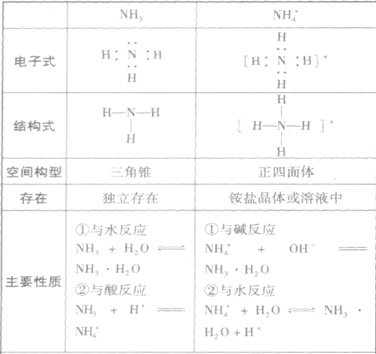
氨:
NH3的电子式为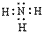 ,结构式为
,结构式为 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为: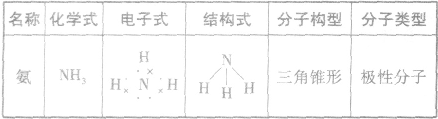
氨的物理性质和化学性质:
1.物理性质:
氨是无色、有刺激性气味的气体,比空气轻;氨易液化,在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热。液态氨气化时要吸收大量的热,使周围的温度急剧下降;氨气极易溶于水,在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);氨对人的眼、鼻、喉等粘膜有刺激作用,若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
2.化学性质:
(1)与水反应, ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。
(2)与酸反应生成铵盐反应实质为:
反应原理拓展NH3分子中N原子有一对孤电子,能够跟有空轨道的H+形成配位键: 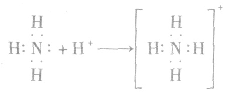
(3)具有还原性  (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
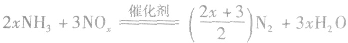 (治理氮氧化物污染)
(治理氮氧化物污染)
(4)与CO2反应制尿素 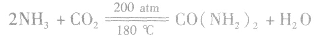
(5)配合反应
 的比较:
的比较:
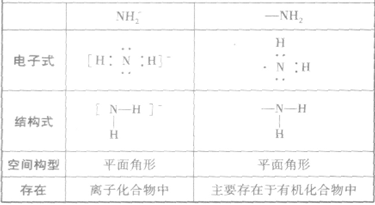
氨的结构与性质的关系总结:

氨的用途:
(1)氨是氮肥工业及制造硝酸、铵盐、纯碱等的重要原料。
(2)氨也是有机合成工业(如制尿素、合成纤维、染料等)上的常用原料。
(3)氨还可用作制冷剂。
对实验室制氨气常见问题的解释:
l.制取氨气时为什么用的铵盐一般是氯化铵而不是硝铵、硫铵或碳铵实验室制氨气用 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为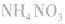 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应: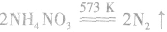
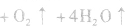 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用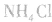 。
。
2.不用铵盐与强碱反应能否制取氨气能。
①加热浓度在20%以上的浓氨水,若浓度不够可加人适量固体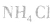 和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 
②将浓氨水滴入盛有固体烧碱或生石灰(CaO)的烧瓶中,使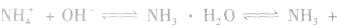
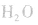 平衡右移,放出
平衡右移,放出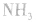 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低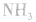 ,在水中的溶解度。
,在水中的溶解度。
③将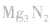 溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 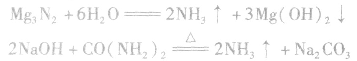
3.为什么制NH3用Ca(OH)2而不用NaOH ①固体NaOH易吸湿结块,不易与铵盐混合充分而反应;②在加热条件下,NaOH易腐蚀玻璃仪器。
4.制NH3的装置有哪些注意事项
①收集装置和发生装置的试管和导管必须是干燥的,因为氨气易溶于水;
②发生装置的试管口略向下倾斜,以免生成的水倒流使试管炸裂;
③导管应插入收集装置的底部,以排尽装置中的空气;
④收集NH3的试管口塞一团棉花,作用是防止NH3与空气形成对流,使收集的NH3较纯,还可防止NH3逸散到空气中。
5.用什么方法收集NH3只能用向下排空气法,因为NH3极易溶于水,密度又比空气小。
6.怎样收集干燥的NH3将NH3通过盛有碱石灰或固体NaOH的干燥管,但不能选用浓 、无水
、无水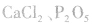 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。
7.怎样检验NH3已充满试管把湿润的红色石蕊试纸放在试管口处,若试纸变蓝,则NH3已充满;把蘸有浓盐酸的玻璃棒接近试管口,若产生大量白烟,则NH3已充满。
与“某同学仿照喷泉实验的原理在化学实验室里做了一个“喷烟实验”...”考查相似的试题有:
- 下列物质中,能使品红溶液褪色的是[ ]A.次氯酸B.臭氧C. 二氧化碳D.二氧化硫
- 将SO2气体通入BaCl2溶液中,没有看到明显现象,再加入或通入一种物质,产生一种白色沉淀,该气体不可能是[ ]A.Cl2B.H2O2C....
- 将过量的SO2气体通入下列溶液中,最终没有沉淀的是( ) A.Na[Al(OH)4]B.BaCl2C.Ba(NO3)2D.NaSiO3
- 下列气体与自来水的消毒有关的是( )A.Cl2B.NO2C.SO2D.NO
- I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是______(填序号).A.实验室中,浓硝酸保存在带橡胶塞的棕色...
- 一定条件下,将6体积的NO2和一定体积的NO与4.5体积的氧气组成的混和气体置于试管中.将试管倒置于水中,充分反应后,剩余1.5...
- 已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:物质A由a、e构成,B、C、D、K都是单质,反应①...
- 下图中的每一个方格表示有关的一种反应物或生成物,其中X为酸式盐,A是能使澄清石灰水变浑浊的无色无味气体,C是能使湿润的红...
- 现有下列四种物质:① SO2②NH3③Na2SO4溶液 ④Fe(OH)3胶体。其中加入氯化钡溶液产生白色沉淀的是______(填序号,下同),能使品...
- 现有A、B、C三种气体,A在一定条件下能与O2反应生成B,B不溶于水,但却能与O2反应生成C,A和C都能溶于水,前者呈碱性,后者呈...