本试题 “NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为( ) A.NH3分子中N为sp2杂化,CH4分子中C为sp3杂化 B.NH3分子中N原子形成3个杂化轨道,CH4分子中...” 主要考查您对无机分子的立体结构
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 无机分子的立体结构
分子中原子的空间关系是分子表现出不同的空间构型。
用价层电子对互斥理论确定分子或离子的VSEPR模型和立体构型的方法:
首先计算分子或离子中的中心原子的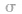 键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
1.价层电子对数的确定方法
(1) 键电子对数:由分子式确定,中心原子形成的
键电子对数:由分子式确定,中心原子形成的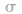 键的数目就是
键的数目就是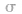 键电子对数。如
键电子对数。如 分子中的中心原子
分子中的中心原子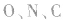 分别有2、3、4对
分别有2、3、4对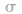 键电子对。
键电子对。
(2)孤电子对数
①分子中的中心原子上的孤电子对数
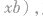 式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
以 为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则
为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则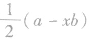 分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
②对于阳离子,a为中心原子的价电子数减去离子的电荷数;对于阴离子,a为中心原子的价电子数加上离子的电荷数(绝对值)。x和b的计算方法及计算公式[中心原子上的孤电子对数= ]均不变。
]均不变。
2.确定分子(或离子)的VSEPR模型
根据价层电子对数和价层电子对的相互排斥,可得出分子或离子的VSEPR模型,其关系如下表。 
3.确定分子(或离子)的立体构型略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型,如上表。
(1)分子或离子中的价层电子对数分别为2、3、4,则其VSEPR模型分别为直线形、平面三角形、正四面体形或四面体形。如果价层电子对数为5,则为三角双锥形;如果为6,则为正八面体形或八面体形。
(2)如果中心原子的孤电子对数为0,则VSEPR模型(及名称)和分子或离子的立体构型(及名称)是一致的;若孤电子对数不为0,则二者不一致。
与“NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为( ...”考查相似的试题有:
- 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。试回答下列问题:(1 )请写出元素N 的基态原子电子排布式 ...
- 已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被Cl-和H2O取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数...
- 下列化学式对应的结构式从成键情况看不合理的是
- 三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是( )A.PCl3分...
- 下列性质符合分子晶体的是: A.熔点1070℃,易溶于水,水溶液能导电B.熔点是10.31℃,液体不导电,水溶液能导电C.熔点97.81℃...
- 下列说法中正确的是[ ]A.离子化合物中一定不含共价键,共价化合物中一定不含离子键B.水分子呈直线形,氨分子呈三角锥形C....
- 你认为下列说法不正确的是( )A.氢键存在于分子之间,不存在于分子之内B.对于组成和结构相似的分子,其范德华力随着相对分子...
- PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:(1)P...
- 下列物质中,只有离子键的是A.MgF2B.Al2O3C.NH4ClD.H2O
- A+、B+、C-、D、E五种微粒(分子或离子),每个微粒均含有10个电子.已知:①A++C-加热D+E↑ ②B++C-→2D请回答以下问题:(1)C-...