本试题 “一化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究.请按要求完成下列研究报告.【资料获悉】36.5%的浓盐酸的密度为1....” 主要考查您对测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
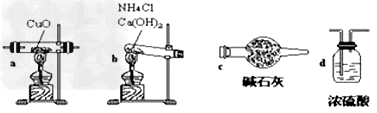
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
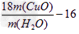
发现相似题
与“一化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液(以下简...”考查相似的试题有:
- 为测定某钢样组成,现取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况).(1)计算...
- 据下图提供的仪器装置,完成提纯并测定Na2CO3样品的纯度(其中含NaHCO3杂质)。请回答下列问题:实验一测定Na2CO3样品中NaHCO...
- 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。请回答下列问题。(1)仪...
- 三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ).制三氯化铬的流...
- 为了探究碱式碳酸镁[mMgCO3·nMg(OH)2·xH2O]的组成,某化学小组仅利用下列仪器组装一套完整装置进行实验(夹持仪器省略)。回...
- 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作...
- 草酸晶体的组成可表示为:H2C2O4·XH2O,为测定X值,进行下列实验:①称取wg草酸晶体配成100.0mL水溶液;②取25.0mL所配草酸溶液...
- 由短周期元素组成的化合物X是某抗酸药的有效成分。甲同学欲探究X的组成。查阅资料:①由短周期元素组成的抗酸药的有效成分有碳...
- 为了测定草酸晶体(H2C2O4•xH2O)中的x值,进行如下实验(1)称取Wg草酸晶体,配成100.00mL溶液(2)取25.00mL所配溶液于锥形...
- 碱式碳酸镁有多种不同的组成,如:Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mgg(OH)2(CO3)4等.某研究性学习小组的同学们为了...