本试题 “请从氮气、氧气、氦气、二氧化碳、二氧化硫等五种气体中,按要求将相应物质的化学式填写在题中的空白处。(1)能支持燃烧的气体是_________;(2)可被植物用...” 主要考查您对酸雨
氧气的性质
氮气的性质和用途
二氧化碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸雨
- 氧气的性质
- 氮气的性质和用途
- 二氧化碳的性质
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2
 SO2
SO2 二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2
 2NO
2NO 一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
知识拓展:
1. 酸雨区
某地收集到酸雨样品,还不能算是酸雨区,因为一年可有数十场雨,某场雨可能是酸雨,某场雨可能不是酸雨,所以要看年均值。目前我国定义酸雨区的科学标准尚在讨论之中,但一般认为:年均降水pH高于5.65,酸雨率是0-20%,为非酸雨区;pH在5.30--5.60之间,酸雨率是10--40%,为轻酸雨区;pH在5.00--5.30之间,酸雨率是30-60%,为中度酸雨区;pH在4.70--5.00之间,酸雨率是50-80%,为较重酸雨区;pH小于4.70,酸雨率是70-100%,为重酸雨区。这就是所谓的五级标准。其实,北京、拉萨、西宁、兰州和乌鲁木齐等市也收集到几场酸雨,但年均pH和酸雨率都在非酸雨区标准内,故为非酸雨区。
2. 我国三大酸雨区
我国酸雨主要是硫酸型
我国三大酸雨区分别为:
(1)西南酸雨区:是仅次于华中酸雨区的降水污染严重区域。
(2)华中酸雨区:目前它已成为全国酸雨污染范围最大,中心强度最高的酸雨污染区。
(3)华东沿海酸雨区:它的污染强度低于华中、西南酸雨区。
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体)
 液氮(淡蓝色液体)
液氮(淡蓝色液体)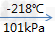 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2
 2MgO
2MgO3Fe+2O2
 Fe3O4
Fe3O4②与非金属的反应:
C+O2
 CO2(O2充分)
CO2(O2充分)2C+O2
 2CO(O2不充分)
2CO(O2不充分)③与化合物的反应:
2CO+O2
 2CO2
2CO2CH4+2O2
 CO2+2H2O
CO2+2H2OC2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
氮气,常况下是一种无色无味无臭的气体,且通常无毒。氮气占大气总量的78.12%(体积分数),是空气的主要成份。常温下为气体,在标准大气压下,冷却至-195.8℃时,变成没有颜色的液体,冷却至-209.86℃时,液态氮变成雪状的固体。氮气的化学性质很稳定,常温下很难跟其他物质发生反应,但在高温、高能量条件下可与某些物质发生化学变化,用来制取对人类有用的新物质。
物理性质:
(1)无色无味的气体
(2)不易溶于水
(3)在标准状况下密度为1.251g/L,密度比空气略小
化学性质:
化学性质不活泼,一般情况下不能燃烧,也不支持燃烧;在常温下难与其他物质发生反应,但在高温下也能与一些物质发生化学反应。
用途:
(1)焊接金属时做保护气
(2)灯泡中填充氮气以延长灯泡的使用寿命,食品包装袋中充有氮气以防止食品腐烂变质
(3)医疗上可以在液氮冷冻麻醉的条件下做手术
(4)超导材料在液氮的低温环境下能显示超导性能
(5)制造氮肥和硝酸
(6)有些博物馆把贵重罕见的书画,墨宝保存在充满氮气的圆筒中,既可以避免氧化变质,又可防止虫蛀霉变。
氮的化学性质:
1. 氮化物反应
氮化镁与水反应:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
在放电条件下,氮气才可以和氧气化合生成一氧化氮:N2+O2=放电=2NO
一氧化氮与氧气迅速化合,生成二氧化氮2NO+O2=2NO2
二氧化氮溶于水,生成硝酸,一氧化氮3NO2+H2O=2HNO3+NO
五氧化二氮溶于水,生成硝酸,N2O5+H2O=2HNO3
2. 氮和活泼金属反应
N2与金属锂在常温下就可直接反应:6Li+N2===2Li3N
N2与碱土金属Mg、Ca、Sr、Ba在炽热的温度下作用:3Ca+N2===Ca3N2
N2与镁条反应:3Mg+N2=点燃=Mg3N2(氮化镁)
3. 氮和非金属反应
N2与氢气反应制氨气:N2+3H2===(可逆符号)2NH3
N2与硼要在白热的温度才能反应:2B+N2===2BN(大分子化合物)
N2与硅和其它族元素的单质一般要在高于1473K的温度下才能反应。
氮气用途——汽车轮胎
1.提高轮胎行驶的稳定性和舒适性
氮气几乎为惰性的双原子气体,化学性质极不活泼,气体分子比氧分子大,不易热胀冷缩,变形幅度小,其渗透轮胎胎壁的速度比空气慢约30~40%,能保持稳定胎压,提高轮胎行驶的稳定性,保证驾驶的舒适性;氮气的音频传导性低,相当于普通空气的1/5,使用氮气能有效减少轮胎的噪音,提高行驶的宁静度。
2.防止爆胎和缺气碾行
爆胎是公路交通事故中的头号杀手。据统计,在高速公路上有46%的交通事故是由于轮胎发生故障引起的,其中爆胎一项就占轮胎事故总量的70%。汽车行驶时,轮胎温度会因与地面磨擦而升高,尤其在高速行驶及紧急刹车时,胎内气体温度会急速上升,胎压骤增,所以会有爆胎的可能。而高温导致轮胎橡胶老化,疲劳强度下降,胎面磨损剧烈,又是可能爆胎的重要因素。而与一般高压空气相比,高纯度氮气因为无氧且几乎不含水份不含油,其热膨胀系数低,热传导性低,升温慢,降低了轮胎聚热的速度,不可燃也不助燃等特性,所以可大大地减少爆胎的几率。
3.延长轮胎使用寿命
使用氮气后,胎压稳定体积变化小,大大降低了轮胎不规则磨擦的可能性,如冠磨、胎肩磨、偏磨,提高了轮胎的使用寿命;橡胶的老化是受空气中的氧分子氧化所致,老化后其强度及弹性下降,且会有龟裂现象,这时造成轮胎使用寿命缩短的原因之一。氮气分离装置能极大限度地排除空气中的氧气、硫、油、水和其它杂质,有效降低了轮胎内衬层的氧化程度和橡胶被腐蚀的现象,不会腐蚀金属轮辋,延长了轮胎的使用寿命,也极大程度减少轮辋生锈的状况。
4.减少油耗,保护环境
轮胎胎压的不足与受热后滚动阻力的增加,会造成汽车行驶时的油耗增加;而氮气除了可以维持稳定的胎压,延缓胎压降低之外,其干燥且不含油不含水,热传导性低,升温慢的特性,减低了轮胎行走时温度的升高,以及轮胎变形小抓地力提高等,降低了滚动阻力,从而达到减少油耗的目的。
二氧化碳是空气中常见的化合物,其分子式为CO?,由两个氧原子与一个碳原子通过共价键连接而成,常温下是一种无色无味气体,密度比空气略大,能溶于水,与水反应生成碳酸。固态二氧化碳俗称干冰。二氧化碳被认为是造成温室效应的主要来源。
物理性质:
常温下,二氧化碳是一种无色无味的气体,密度比空气大,能溶于水。
固态的二氧化碳叫做干冰。
化学性质:
(1)一般情况下,二氧化碳不能燃烧,也不支持燃烧,不供给呼吸,因此当我们进入
干枯的深井,深洞或久未开启的菜窖时,应先做一个灯火实验,以防止二氧化碳浓度
过高而造成危险
(2)二氧化碳和水反应生成碳酸,使紫色石蕊试液变红:CO2 + H2O===H2CO3,
碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变回紫色:
H2CO3===H2O + CO2↑
(3)二氧化碳和石灰水反应:Ca(OH)2 + CO2====CaCO3↓+ H2O
(4)二氧化碳可促进植物的光合作用:6CO2+6H2O
 C6H12O6+6O2
C6H12O6+6O2 一氧化碳和二氧化碳性质的比较:
|
|
|
一氧化碳 |
二氧化碳 |
|
物理性质 |
状态 |
无色,无味气体 |
无色,无味气体 |
|
密度 |
1.250g/l(略小于空气) |
1.977g/l(大于空气) | |
|
溶解性 |
1体积水中约溶解0.02体积 |
1体积中约溶解1体积 | |
|
化学性质 |
可燃性 |
有可燃性 |
一般情况下,既不能燃烧,也不能支持燃烧 |
|
还原性 |
有还原性: |
没有还原性 | |
|
跟水反应 |
不能 |
能:CO2+H2O==H2CO3 | |
|
跟澄清石灰水反应 |
不能 |
CO2+Ca(OH)2==CaCO3↓+H2O | |
|
毒性 |
有毒 |
无毒 | |
|
主要用途 |
作气体燃料,用于高炉炼铁 |
灭火,人工降雨,干冰制冷剂等,作化工原料和温室肥料 | |
|
相互转化 |
C+O2 CO2 CO2C+CO2  2CO 2CO | ||
干冰:
一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫“干冰”。干冰升华时,吸收大量的热,因此可作制冷剂。如果用飞机向云层中撤干冰,由于干冰升华吸热,空气中的水蒸气迅速冷凝变成水滴,就可以形成降雨。
二氧化碳不一定能灭火:
二氧化碳一般不支持燃烧,但在一定条件下,某些物质也可以在二氧化碳中燃烧,如将点燃的镁条伸入盛有二氧化碳的集气瓶中,镁条能继续燃烧,反应的化学方程式为:2Mg+CO2
 2MgO+C,所以活泼金属着火不能用二氧化碳来灭火
2MgO+C,所以活泼金属着火不能用二氧化碳来灭火 二氧化碳与一氧化碳的鉴别方法:
(1)澄清石灰水:将气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,无明显现象的是一氧化碳。
(2)燃着的木条:将气体分别在空气中点燃,能燃烧的是一氧化碳,不能燃烧的是二氧化碳。
(3)紫色石蕊试液:将气体分别通入紫色石蕊试液中,能使石蕊试液变红的是二氧化碳,无明显现象的是一氧化碳。
(4)还原金属氧化物:将气体分别通过灼热的氧化铜,出现黑色粉末变红这一现象的是一氧化碳,没有明显现象的是二氧化碳。
二氧化碳与一氧化碳的除杂方法:
1.CO(CO2)(括号内的物质为杂质):通常将气体通人过量的碱溶液(一般用氢氧化钠溶液而不用澄清石灰水)中,二氧化碳与碱溶液反应,从而达到除杂的目的。
2.CO2(CO)(括号内的物质为杂质):通常将气体通过灼热的氧化铜,一氧化碳与氧化铜反应生成铜和二氧化碳,从而达到除杂的目的。不能用点燃的方法,因为CO2不支持燃烧,也不能燃烧。
二氧化碳与石灰石的应用:
二氧化碳与石灰水反应出现白色沉淀,反应的方程式为:CO2+Ca(OH)2==CaCO3↓+H2O。
该反应及现象有以下儿方面的应用:
(1)检验二氧化碳气体;
(2)鉴别NaOH溶液和澄清石灰水:将CO2气体通入待测溶液中,生成白色沉淀的溶液为澄清石灰水,无明显现象的为NaOH溶液;
(3)除去某些气体中的杂质:如除去CO中的CO2 气体,可将混合气体通过澄清石灰水;
(4)解释澄清石灰水为什么要密封保存:敞口放置的澄清石灰水会吸收空气中的CO2而使澄清石灰水表面生成一层白膜或变浑浊,其成分是CaCO3;
(5)用石灰砂浆砌砖抹墙不久后变白变硬:石灰砂浆的主要成分是Ca(OH)2,吸收空气中的CO2发生反应Ca(OH)2声称白色固体CaCO3固体。
(6)保存鸡蛋:将鸡蛋浸泡在澄清石灰水中,取出来后CO2与石灰水反应封闭鸡蛋壳上的小孔,可以延长鸡蛋的保存时间。
二氧化碳肥料:
二氧化碳是光合作用的原料之一,因而现在在温室大棚内种植蔬菜水果时,经常人为提高温室内CO2 浓度,以增加农作物产员,增大CO2浓度的方法通常有以下几种:
(1)在温室内放置干冰,干冰升华增大CO2浓度。
(2)在温室内放置通过化学反应产生CO2气体的物质,如在塑料大棚顶部的容器内放置石灰石和稀盐酸。
灯火实验:
(1)二氧化碳本身无毒,但它不供给呼吸,当空气中二氧化碳含量超过常量时,也会对人体健康产生不良影响。
| 空气中二氧化碳的体积分数/% | 对人体健康的影响 |
| 1 | 感到气闷,头昏,心悸 |
| 4—5 | 气喘,头痛,眩晕 |
| 10 | 神志不清,呼吸停止,死亡 |
与“请从氮气、氧气、氦气、二氧化碳、二氧化硫等五种气体中,按...”考查相似的试题有:
- 某镇硫酸厂以煤为原料生产,该镇经常下酸雨.请回答:(1)酸雨的pH______5.6(填:>、<、=),造成该镇经常下酸雨的主要原...
- 下列说法中不正确的是( )A.氧气的化学性质很活泼,能与很多物质发生化学反应B.用向上排气法可以收集密度比空气大的气体C...
- 在学校运动会上,发令枪打响时产生的白烟主要是( )A.二氧化硫B.五氧化二磷C.水蒸气D.二氧化碳
- 下面是某同学通过一年的化学学习,对所学化学知识进行归纳的情况。(1 )对环境污染及治理方法连线正确的是 ;A 、减缓“温室...
- 把如图实验装置的(1)至(5)各部分发生的现象和反应的化学方程式填入下表.装置现象化学方程式(1) (2) (3) (4) (5)
- 下列选项中对部分化学知识的归纳完全正确的一组是( )A.健康常识人体缺铁元素会贫血人体缺碘元素会得侏儒症B.生活常识热水...
- 火灾是燃烧最常见的危害,燃烧还能引起爆炸.破坏燃烧条件可以灭火,避免爆炸.家庭炒菜时油锅着火可用锅盖盖灭,所用原理是_...
- 有两种黑色粉末A、B和两种无色气体C、D,用下面的装置图所示的装置做了以下实验:第一步:当加热管内盛有的黑色粉末A时,由a...
- 根据下图所示实验,回答下列问题.(1)仪器a的名称是______,A装置中发生反应的化学方程式为______.(2)B装置中,分别加入...
- 推断题:某无色液体A,在一定条件下发生的变化和现象如下所示根据以上条件和现象判A~G各是什么物质,用化学式表示出来A_____...
 2CO2
2CO2 Cu+CO2
Cu+CO2