本试题 “图所示,向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(20℃)的烧杯中,再向试管中滴入约5mL盐酸,如图所示.请回答:(1)实验中观察到的明显现象有...” 主要考查您对化学反应中的能量变化
固体溶解度
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应中的能量变化
- 固体溶解度
定义:
化学反应不仅有物质的变化,还伴随着能量的变化,通常表现为热量变化。有些化学反应会放出热量(称为放热反应),如燃烧、镁和盐酸反应等;也有些反应会吸收热量(称为吸热反应),如碳与二氧化碳反应(C+CO2 2CO)。
2CO)。
常见的吸热反应:
化学上把最终表现为吸收热量的反应叫吸热反应,初中化学所涉及的吸热反应主要有以下几种:
①C+CO2 2CO
2CO
C+2CuO 2Cu+CO2↑
2Cu+CO2↑
CaCO3 CaO+CO2↑
CaO+CO2↑
3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
可见,一般反应条件为高温的反应是吸热反应。
常见的放热反应:
化学上把最终表现为放出热量的反应叫放热反应,初中化学所涉及的放热反应主要有以下几种:
①燃烧:所有燃烧均会放热,如CH4+2O2 CO2+2H2O,H2+Cl2
CO2+2H2O,H2+Cl2 2HCl;
2HCl;
②酸碱中和:酸与碱反应生成盐和水,同时放出热量,如H2SO4+2NaOH==Na2SO4+2H2O
③活拨金属与酸发生置换反应生成H2,同时放出热量,如Mg+2HCl==MgCl2+H2↑,Zn+H2SO4== ZnSO4+H2↑。
④缓慢氧化也是放热反应,如铁生锈、食物腐烂过程中均放出热量。
⑤其他:如双氧水分解是放热反应
人类生活对能量的利用:
①生活燃料的利用:做饭、取暖等;
②利用燃料烧烧产生的能量:发电、制陶瓷、冶炼金属和发射火箭;
③利用爆炸产生的巨大能量:开山炸石、拆除违规建筑;
④食物在体内发生缓慢氧化放出热量,维持体温
化学反应不仅有物质的变化,还伴随着能量的变化,通常表现为热量变化。有些化学反应会放出热量(称为放热反应),如燃烧、镁和盐酸反应等;也有些反应会吸收热量(称为吸热反应),如碳与二氧化碳反应(C+CO2
 2CO)。
2CO)。 常见的吸热反应:
化学上把最终表现为吸收热量的反应叫吸热反应,初中化学所涉及的吸热反应主要有以下几种:
①C+CO2
 2CO
2CO C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ CaCO3
 CaO+CO2↑
CaO+CO2↑ 3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2 可见,一般反应条件为高温的反应是吸热反应。
常见的放热反应:
化学上把最终表现为放出热量的反应叫放热反应,初中化学所涉及的放热反应主要有以下几种:
①燃烧:所有燃烧均会放热,如CH4+2O2
 CO2+2H2O,H2+Cl2
CO2+2H2O,H2+Cl2 2HCl;
2HCl;②酸碱中和:酸与碱反应生成盐和水,同时放出热量,如H2SO4+2NaOH==Na2SO4+2H2O
③活拨金属与酸发生置换反应生成H2,同时放出热量,如Mg+2HCl==MgCl2+H2↑,Zn+H2SO4== ZnSO4+H2↑。
④缓慢氧化也是放热反应,如铁生锈、食物腐烂过程中均放出热量。
⑤其他:如双氧水分解是放热反应
人类生活对能量的利用:
①生活燃料的利用:做饭、取暖等;
②利用燃料烧烧产生的能量:发电、制陶瓷、冶炼金属和发射火箭;
③利用爆炸产生的巨大能量:开山炸石、拆除违规建筑;
④食物在体内发生缓慢氧化放出热量,维持体温
概念:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
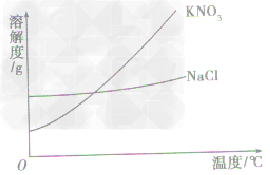
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
发现相似题
与“图所示,向试管中放入几小块镁片,把试管固定在盛有饱和石灰...”考查相似的试题有:
- 下列有关氢气的叙述中正确的是( )A.氢气可以通过电解水的方法得到,目前的电力足以保证这一方法的顺利推广B.氢气和空气混...
- 合肥市早在几年前引进了天然气,相比煤、煤气天然气污染小,价格低廉,是市民们首选的经济、清洁能源.(1)天然气属于 能源...
- 下列说法不科学的是( )A.煤、石油、天然气不完全燃烧会造成空气污染B.将旧废电池集中处理,防止土壤污染C.氢气是一种理...
- 在化学学习中,我们能够总结出许多“三”,以下关于“三”的图形表达错误的是( ) A.B.C.D.
- 下图是A、B、C三种物质的溶解度曲线。据图,回答下列问题。(1)10℃时,B物质的溶解度为 g。(2)30℃时,三种物质溶解度从大...
- 下表是KNO3、NaCl在不同温度下的部分溶解度数据(单位:g/100g水),请回答问题:温度(℃)1020406080KNO320.931.663.9110169...
- 下列说法中,正确的是[ ]A、浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液B、温度升高时,物质的溶解度都增大C、凡是...
- 甲、乙、丙三种物质的溶解度曲线如下图所示。(1)40℃时, 的溶解度最大;(2)将60℃时甲、乙、丙的饱和溶液降温至40℃,三种...
- 下列有关基本概念和原理的说法正确的是( )A.纯净物不一定由同种分子构成B.质子数相同的粒子一定属于同种元素C.电离时产...
- 10℃时,在两个烧杯中分别盛有相同质量的硝酸钾和氯化钾饱和溶液;保持溶液温度不变,分别向其中加入等质量的相应溶质;再将温...