本试题 “下列说法正确的是( )A.质子数相同的粒子一定是同种元素B.只含有一种元素的物质一定是纯净物C.离子晶体和原子晶体中都不存在单个分子D.分子式相同的物质...” 主要考查您对物质的简单分类
原子晶体
离子晶体
元素的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的简单分类
- 原子晶体
- 离子晶体
- 元素的性质
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
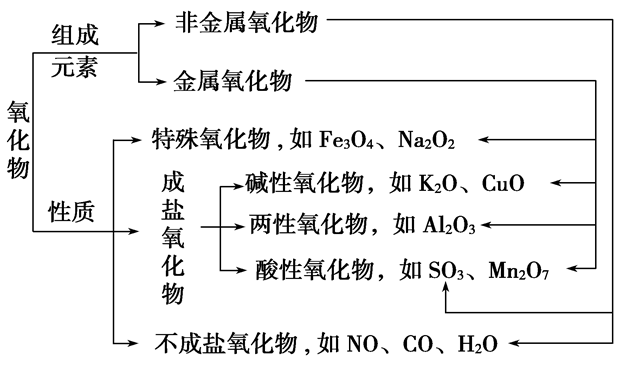
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:

氧化物的分类:
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
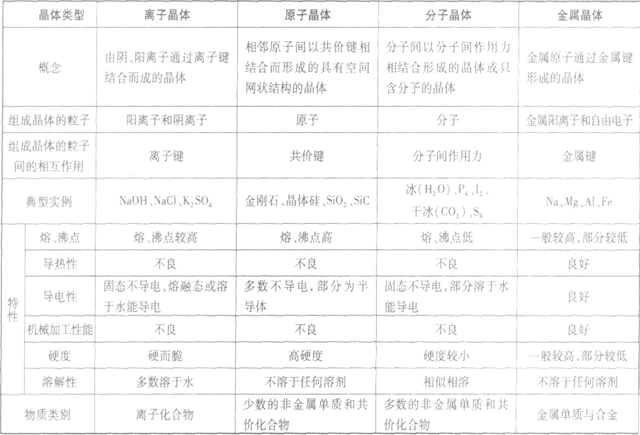
晶体的基本类型与性质:
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
离子间通过离子间结合而形成的晶体,熔点较高、沸点高,导热性、延展性不良,固态不导电、熔融或溶于水导电,脆而硬,如:NaCl
晶体的基本类型与性质:

晶体类型的判断方法:
1.依据晶体的组成微粒与微粒间作用力来判断
离子晶体的组成微粒是阴、阳离子,微粒间作用力是离子键;原子晶体的组成微粒是原子,微粒间作用力是共价键;分子晶体的组成微粒是分子,微粒间作用力是分子间作刚力;金属晶体的组成微粒是金属阳离子和自南电子,微粒间作用力是金属键。
2.依据物质的分类判断
金属氧化物(如K2O、Na2O等)、强碱(如NaOH、 KOH等)和绝大多数的盐是离子晶体。大多数非金属单质(除金刚石、石墨、品体硅、晶体硼以外)、气态氢化物、非金属氧化物(除SiO2以外)、酸、绝大多数有机物 (除有机盐以外)都是分子晶体。常见的属于原子晶体的单质有金刚石、晶体硅、晶体硼、晶体锗等,常见的属于啄子品体的化合物有碳化硅(SiC)、氮化硅(Si3N4)、氮化硼(BN)、二氧化硅(SiO2)等。金属单质与合金是金属晶体.
3.依据晶体的熔点判断
离子晶体熔点较高,常在几百至一千摄氏度。原子晶体熔点高,常在一千至几千摄氏度。分子晶体熔点低,常在几百摄氏度以下至很低的温度。金属晶体的熔点范围最广,钨的熔点比部分原子晶体还要高,汞的熔点比部分分子晶体还要低。
4.依据导电性判断离子晶体水溶液及熔化时能导电、原子晶体一般为非导体。分子晶体为非导体,但分子晶体中的电解质溶于水,使分子内的化学键断裂形成自由离子也能导电。金属晶体是电的良导体。
5.依据硬度和机械性能判断
离子晶体硬度大(或硬而脆);分子晶体硬度较小;原子晶体硬度大;金属晶体多数硬度大,但也有较小的,具有延展性。
由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。
碱金属元素的性质:
(1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强
(2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
(3)化合物性质
同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。
注: ①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。 ②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2
 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。 (2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
与“下列说法正确的是( )A.质子数相同的粒子一定是同种元素B....”考查相似的试题有:
- 下列各组物质的分类正确的是( )①混合物:氯水、氨水、水玻璃、水银②电解质:明矾、冰醋酸、石膏、纯碱 ③同位素:H+、2H+、3...
- 下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )A.蒸馏水、氨水、氧化铝、二氧化硫B.纯盐酸、空气、硫...
- 下列叙述正确的是A.含金属元素的离子不一定是阳离子B.一种元素可形成多种离子,但只能是带同种电荷的离子C.由同种元素组成...
- 下列各组均有四种物质,其中有一种物质与其他三种物质的类别不同,请将该物质的化学式或名称填在横线上(1)CuO NO2NaOH Fe2O...
- 分类是化学学习和研究中常用的思维方法,下列关于化学物质和反应类型关系正确的是A.B.C.D.
- 下列的晶体中,化学键种类相同,晶体类型也相同的是[ ]A.SO2与SiO2B.CO2与H2OC.NaCl与HClD.CCl4与KCl
- 20世纪中期,科学家发现并证明,碳还以新的单质形态C60存在,后来人们又相继得到了C70、C76、C84、 C90、C94等另外一些球碳分...
- 下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是A.Al(OH)3B.Fe(OH)3C.SiO2D.SO2
- 生产、生活离不开各种化学物质,下列说法不正确的是( )。A.不需要通过化学反应就能从海水中获得食盐和淡水B.潜水艇在紧急情...
- 下列有关叙述正确的是A.Li在空气中燃烧主要生成Li2O2B.CO2、SO2、NO2都能和碱溶液发生反应, 因此它们都属于酸性氧化物C.用...