本试题 “第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。(1)下列叙述正确的是______(填字母)。A.CH2O与水分子间能形成氢键B.CH2O和CO2分子中的中心原子均...” 主要考查您对电子排布式
极性分子、非极性分子
杂化轨道理论(中心原子杂化方式)
晶胞
原子晶体
分子晶体
元素周期表
电负性
等电子原理(等电子体)
氢键
同分异构体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电子排布式
- 极性分子、非极性分子
- 杂化轨道理论(中心原子杂化方式)
- 晶胞
- 原子晶体
- 分子晶体
- 元素周期表
- 电负性
- 等电子原理(等电子体)
- 氢键
- 同分异构体
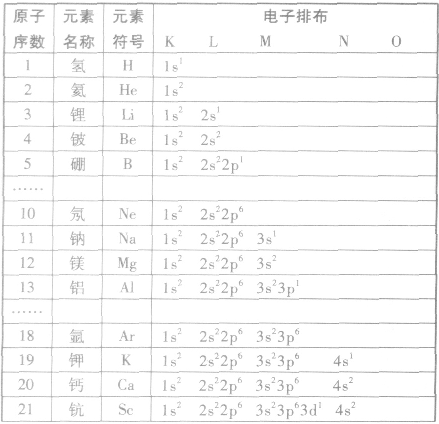
电子排布式:
①简化电子排布式
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的冗素符号外加方括号表示,即为简化电子排布式,如K 的简化电子排布式为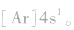
②特殊电子排布式
有个别元素的基态原子的电子排布对于构造原理有1个电子的反常。因为能量相同的原子轨道在全充满( )、半充满(
)、半充满(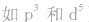 )和全空(
)和全空(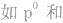
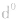 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。 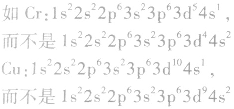
(2)电子排布图:用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。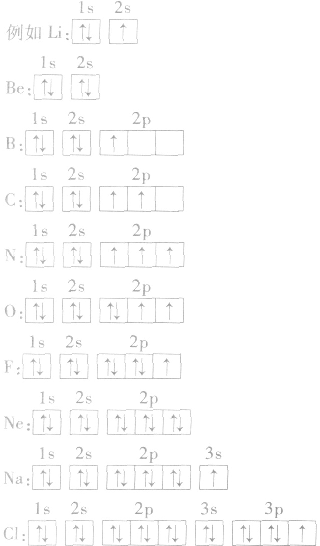
构造原理:
多电子原子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。绝大多数元素的原子核外电子的排布遵循下图所示的排布顺序,这种排布顺序被称为构造原理。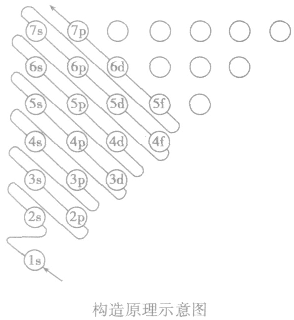
点拨:构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由下列公式得出ns<(n一2)f< (n一1)d<np(n表示能层序数)。常用的重要的能级交错顺序有: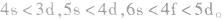
核外电子排布式一构造原理的应用:
根据构造原理,按照能级顺序,用能级符号右上角的数字表示该能级上电子数的式子,叫做电子排布式。例如,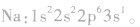
(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
非极性分子和极性分子的比较:
| 非极性分子 | 极性分子 | |
| 形成原因 | 整个分子的电荷分布均匀,对称 | 整个分子的电荷分布不均匀、不对称 |
| 存在的共价键 | 非极性键或极性键 | 极性键 |
| 分子内原子排列 | 对称 | 不对称 |

分子极性的判断方法:
An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
1.根据分子的立体构型判断
判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。比如H2O分子中虽然2个H原子轴对称,但整个分子的空间构型是不对称的: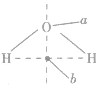 ,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
2.根据实验现象判断
将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
3.根据中心原子最外层电子是否全部成键判断
ABn型分子中的中心原子A的最外层电子若全部成键(没有孤电子对),此分子一般为非极性分子,如CO2、CCl4等;分子中的中心原子最外层电子若未全部成键(有孤电子对),此分子一般为极性分子,如H2O、 PCl3等。
4.判断ABn型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。如BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,是非极性分子;H2O、 NH3、SO2、PCl3等分子中,O、N、S、P等元素的化合价的绝对值不等于其主族序数,是极性分子。
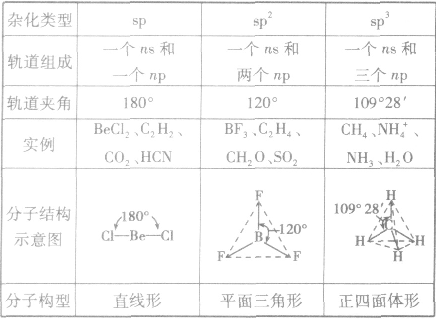
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有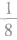 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有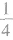 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有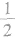 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×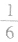 +2×
+2×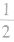 =3,硼原子个数为6。
=3,硼原子个数为6。 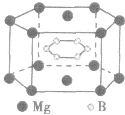
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
晶体的基本类型与性质:
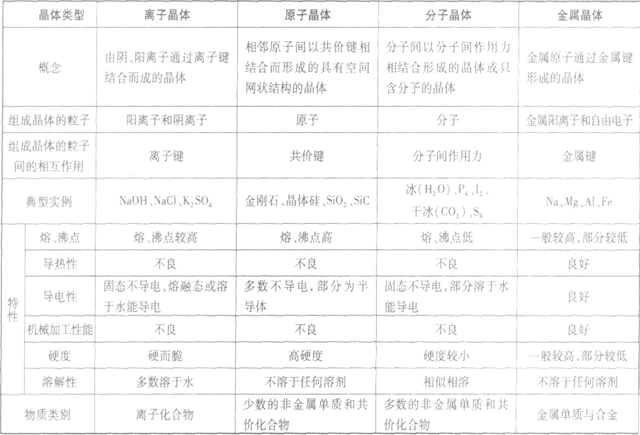
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 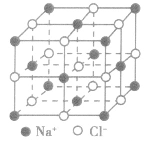 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 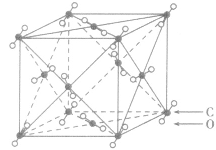 |
| 金刚石晶体 |  |
| SiO2晶体 | 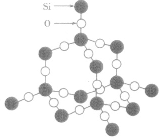 |
| 石墨晶体 (混合晶体) | 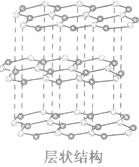 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
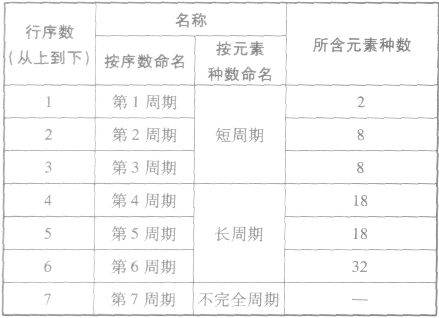
(2)族
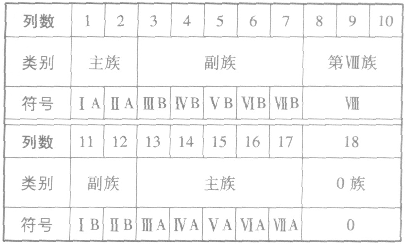
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
电负性:
(1)键合电子、电负性的定义
元素相互化合时,原子中用于形成化学键的电子称为键合电子。电负性用来描述不同元素的原子对键合电子吸引力的大小。
(2)电负性的意义:电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0作为相对标准。
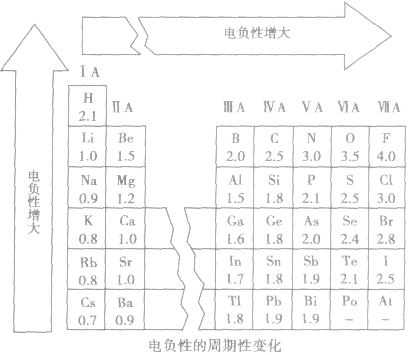
(4)电负性的变化规律
①随原子序数的递增,元素的电负性呈周期性变化。
②同周期,从左到右,元素的电负性逐渐变大。
③同主族,从上到下,元素的电负性逐渐变小。
电负性的应用:
①判断元素的金属性和非金属性的强弱
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②判断元素化合价的正负
利用电负性可以判断化合物中元素化合价的正负:电负性大的元素易呈现负价,电负性小的元素易呈现正价。
③判断化学键的类型
一般认为,如果成键原子所属元素的电负性差值大于 1.7,它们之间通常形成离子键;如果成键原子所属元素的电负性差值小于1.7,它们之间通常形成共价键。
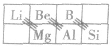
④解释“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如右图所示)的有些性质是相似的,被称为“对角线规则”。例如:硼和硅的含氧酸盐都能形成玻璃且互熔,含氧酸都是弱酸等。
等电子原理:
1.等电子原理等电子体具有相似的化学键特征,它们的结构相似,物理性质相近,此原理称为等电子原理。例如,CO和N2的熔沸点、溶解性、分子解离能等都非常相近。
2.等电子粒子电子数相同的粒子(原子、分子、离子)称为等电子粒子。
常见的等电子粒子: 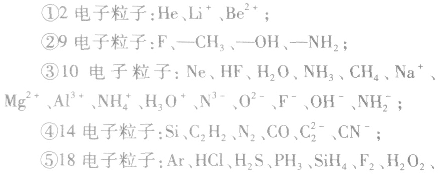
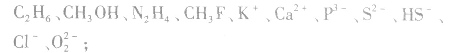
⑥核外电子总数及质子数均相等的粒子: 
3.等电子体
(1)原子总数相同、价电子总数相同的粒子互称为等电子体。如N2与CO是等电子体,但N2与C2H2不是等电子体;O2与SO2是等电子体。
(2)常见的等电子体
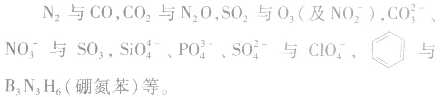
4.等电子原理的应用
(1)利用等电子原理可以较快判断一些分子或离子的构型,如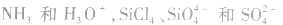 的空间构型分别是三角锥形和正四面体形。
的空间构型分别是三角锥形和正四面体形。
(2)在制造新材料方面有重要应用。如晶体硅、锗是良好的半导体材料,它们的等电子体磷化铝(AIP)、砷化镓(GaAs)也都是良好的半导体材料。,
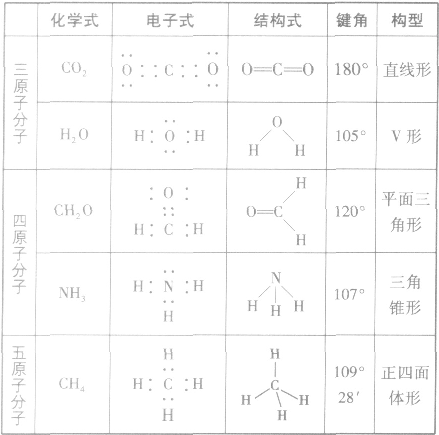
常见分子的立体结构:
氢键:
(1)概念:已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。如水分子问的氢键如下图所示。 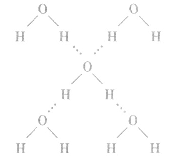
(2)表示方法:A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。
(3)分类
(4)属性:氢键不属于化学键,它属于一一种较强的分子间作用力,其作用能大小介于范德华力和化学键之间。
(5)对物质性质的影响
①氢键对物质熔、沸点的影响。分子问存在氧键时,破坏分子问的氢键,需要消耗更多的能量,所以存在氢键的物质具有较高的熔点和沸点。
例如:氮族、氧族、卤素中的N、O、F的氧化物的熔、沸点的反常现象。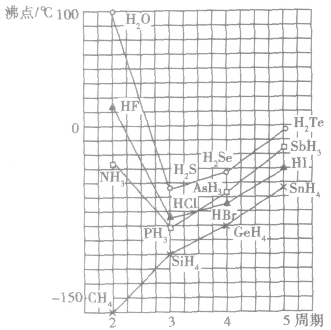
②氢键对物质溶解度的影响:氢键的存在使物质的溶解性增大。例如:NH3极易溶解于水,主要是由于氨分子和水分子之问形成了氢键,彼此互相缔合,因而加大了溶解。再如乙醇、低级醛易溶于水,也是因为它们能与水分子形成氢键。
③氢键的存在会引起密度的变化。水结冰时体积膨胀、密度减小的反常现象也可用氢键解释:在水蒸气中水以单个的水分子形式存在;在液态水中,通常是几个水分子通过氢键结合,形成(H2O)n小集团;在固态水(冰)中,水分子大范围地以氢键互相连接,成为疏松的晶体,因此在冰的结构中有许多空隙,造成体积膨胀,密度减小。
④分子内氢键与分子间氢键对物质性质的不同影响:氢键既可以存在于分子内部的原子之间,也可以存在于分子间的原子之间,只不过这两种情况对物质性质的影响程度是不一样的。例如,邻羟基苯甲醛存在分子内氢键: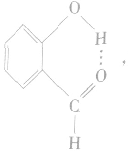 熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键:
熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键: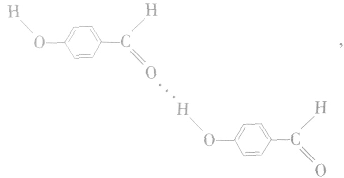 熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
6)存在:水、醇、羧酸、酰胺、氨基酸、蛋白质、结晶水合物等物质中都能存在;生命体中许多大分子内也存在氢键,如氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也是以氢键相互结合的。
同分异构现象和同分异构体:
1.概念:化合物具有相同的分子式.但结构小同,因而产生了性质上的差异,这种现象叫同分异构现象。具有同分异构现象的化合物互为同分异构体。
2.同分异构体的基本类型
(1)碳链异构:指的是分子中碳骨架不同而产生的同分异构现象。如所有的烷烃异构都属于碳链异构。
(2)位置异构:指的是分子中官能团位置不同而产生的同分异构现象。如l一丁烯与2一丁烯、l一丙醇与2一丙醇、邻二甲苯与间二甲苯及对二甲苯。
(3)官能团异构:指的是有机物分子式相同,但具有不同官能团的同分异构体的现象。常见的官能团异构关系如下表所示: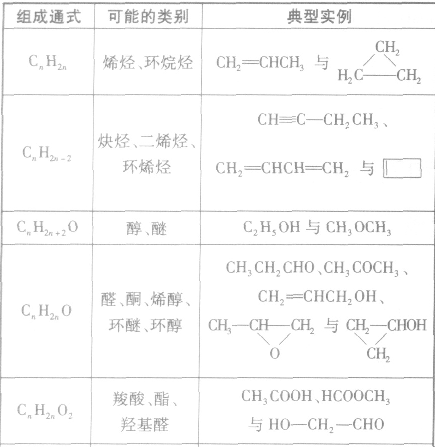
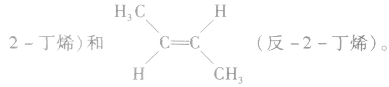
(4)顺反异构:由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象。两个相同的原子或原子团排列在双键的同一侧的称为顺式结构;两个相同的原子或原子团排列在双键的两侧的称为反式结构。如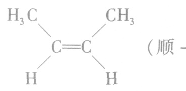
同分异构体的写法:
1.烷烃的同分异构体的写法烷烃只存在碳链异构,其书写技巧一般采用“减碳法”,可概括为“两注意,四句话”。
(1)两注意:①选择最长的碳链为主链;②找出主链的中心对称线。
(2)四句话:主链由长到短、支链由整到散,位置由心到边,排布邻、间、对。
例如,C6H14的同分异构体可按此法完整写出(为了简便,在所写结构式中删去了氢原子): 
2.烯烃的同分异构体的写法分子组成符合CnH2n的烃除烯烃外,还有环烷烃 (n≥3),并且烯烃中双键的位置不同则结构不同,有的烯烃还存在顺反异构,所以烯烃的同分异构体比烷烃复杂得多。以C5H10为例说明同分异构体的写法: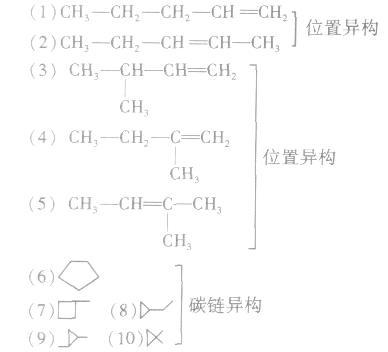
共有5种烯烃,其中(2)还存在顺反异构体,5种环烷烃,共计11种。
3.苯的同系物的同分异构体的写法由于苯环上的侧链位置不同,可以形成多种同分异构体。以C8H10为例写出其属于苯的同系物的同分异构体:
判断同分异构体数目的方法:
1.碳链异构和位置异构:先摘除官能团,书写最长碳链,移动官能团的位置;再逐渐减少碳数,移动官能团的位置。判断分子式为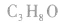 的醇的同分异构体数目:
的醇的同分异构体数目:
先摘除官能团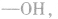 剩余
剩余 和
和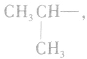 可见有两种属于醇的同分异构体;
可见有两种属于醇的同分异构体;
判断分子式为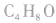 的属于醛的同分异构体数目:
的属于醛的同分异构体数目:
先摘除官能团 剩余
剩余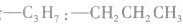 和
和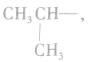 可见有两种属于醛的同分异构体。
可见有两种属于醛的同分异构体。
分子式符合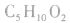 的羧酸的同分异构体数目:
的羧酸的同分异构体数目:
先摘除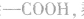 剩余
剩余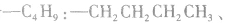
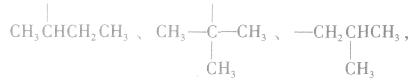 可 见有4种属于酸的同分异构体。
可 见有4种属于酸的同分异构体。
2.官能团衍变:先判断官能团的类别异构,再分别判断同种官能团的异构数目。例如分子式符合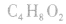 的同分异构体:符合羧酸和酯的通式,属于酸的2种(即摘除
的同分异构体:符合羧酸和酯的通式,属于酸的2种(即摘除 后剩余
后剩余 ),这样一个羧基又可以变为一个醛基和一个羟基,又可以衍变出含有两种不同含氧官能团(含有羟基和醛基)的异构体;属于酯的同分异构体:可以按羧酸和醇的碳数先分类,即酯由一个碳的酸(甲酸)和3个碳的醇(1一丙醇、2一丙醇)得到,酯由2个碳的酸(乙酸)和2个碳的醇(乙醇)得到,酯由3个碳数的酸(丙酸)和1个碳的醇(甲醇)得到,这样就会写出4种酯。
),这样一个羧基又可以变为一个醛基和一个羟基,又可以衍变出含有两种不同含氧官能团(含有羟基和醛基)的异构体;属于酯的同分异构体:可以按羧酸和醇的碳数先分类,即酯由一个碳的酸(甲酸)和3个碳的醇(1一丙醇、2一丙醇)得到,酯由2个碳的酸(乙酸)和2个碳的醇(乙醇)得到,酯由3个碳数的酸(丙酸)和1个碳的醇(甲醇)得到,这样就会写出4种酯。
3.苯环上的位置变换:例如分子式符合 的芳香酯的同分异构体:
的芳香酯的同分异构体: 
4.判断取代产物种类(“一”取代产物:对称轴法; “多”取代产物:一定一动法;数学组合法)。
5.替代法:例如二氯苯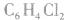 有3种,则四氯苯也为3种(将H替代C1);又如CH4的一氯代物只有一种,新戊烷C(CH3)4的一氯代物也只有一种。
有3种,则四氯苯也为3种(将H替代C1);又如CH4的一氯代物只有一种,新戊烷C(CH3)4的一氯代物也只有一种。
6.对称法(又称等效氢法):等效氢法的判断可按下列三点进行:
(1)同一碳原子上的氢原子是等效的;
(2)同一碳原子所连甲基上的氢原子是等效的;
(3)处于镜面对称位置上的氢原子是等效的(相当于平面成像时,物与像的关系)。
烃的一取代物的数目等于烃分子中等效氢的种数。
与“第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。(1)...”考查相似的试题有:
- 含有非极性键且分子中各原子都满足8电子稳定结构的是( )A.CH4B.CO2C.BeCl2D.N2
- SCl6是一种无色的很稳定的物质,可用于灭火。SCl6的分子结构如图所示,呈正八面体型。如果氯元素有两种稳定的同位素,则SCl6...
- AX4四面体 (A为中心原子,如硅、锗;X为配位原子,如氧、硫) 在无机化合物中很常见。四面体T1按下图所示方式相连可形成一系列...
- 下列晶体中的最小环不是由六个原子构成的是( )A.金刚石B.石墨C.水晶D.晶体硅
- 下列是部分金属元素的电离能XYZ第一电离能(kJ/mol)520.2495.8418.8(1)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化...
- 关于元素周期律和元素周期表的下列说法中正确的是[ ]A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现...
- A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层是最外层电子数的2倍,则关于A、B元素的判断正确的[ ]A.A和B元...
- X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的...
- 下列有关性质的比较,不正确的是( )A.酸性强弱:HI>HBr>HCl>HFB.原子半径大小:Na>S>OC.还原性强弱:F->Cl->I-D...
- 科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。(1)一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热...