本试题 “从能量的角度看,断开化学键要__________,形成化学键要___________。化学反应是释放能量还是吸收能量取决于____________________,当反应物的总能量高于生成...” 主要考查您对化学键与化学反应中能量变化的关系
吸热反应、放热反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学键与化学反应中能量变化的关系
- 吸热反应、放热反应
化学键与化学反应中能量变化的关系:
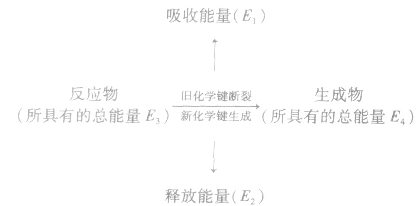
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。
若 反应为放热反应;若
反应为放热反应;若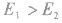 或
或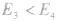 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若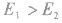 或
或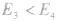 ,反应为吸热反应。
,反应为吸热反应。吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
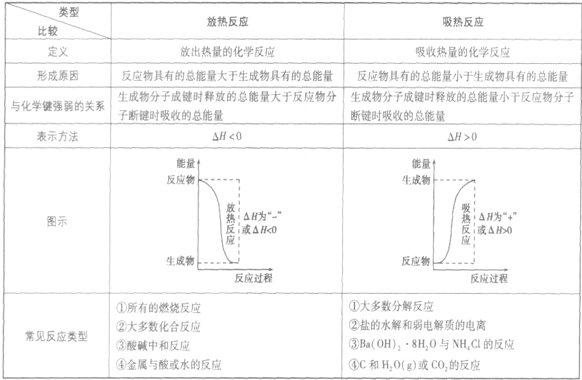
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

发现相似题
与“从能量的角度看,断开化学键要__________,形成化学键要_____...”考查相似的试题有:
- (双选)下列含有共价键的化合物是( )。A.HIB.NaOHC.Br2D.NaCl
- 下列各分子中,所有原子都满足最外层为8电子结构的是A.H2OB.NH3C.Cl2D.BCl3
- 由两种短周期元素构成的某常见离子化合物,阴、阳离子所含的电子数不同,关于该离子化合物的下列说法正确的是( )A.晶体中...
- 下列电子式中正确的是A.B.C.D.
- (6分)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能. 已知部分化学键的键能如下:化学键N—HN—NO==ON≡NO—H键能(kJ/m...
- (14分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。(1)将1 mol CH4和2 mol H2O(g)...
- 下列关于微粒结构的描述正确的是A.CS2为V形的极性分子B.ClO3—的空间构型为平面三角形C.SF6中有6对完全相同的成键电子对D....
- 下列说法中正确的是( )A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键B.含有共价键的物质一定是共价化合物...
- 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:白磷黑磷,黑磷比白磷稳定,结构与石墨相似。...
- 镁化合物和氯气均具有广泛用途,请回答下列问题:(1)写镁和氯气反应产物的电子式____________(2)下图是金属镁和卤素反应...