氮元素在自然界中的存在形式:
既有游离态又有化合态。空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素
氮气的物理性质和化学性质:
(1)物理性质:纯净的氮气是无色气体,密度比空气略小,氮气在水中的溶解度很小,在常压下101kPa,-195.8℃氮气变成无色液体,-209.9℃变成雪花状固体。氮气的分子结构:氮分子(N2)的电子式为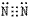 ,结构式为N≡N,由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
,结构式为N≡N,由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
(2)化学性质:氮分子化合价为0价,既可以升高也可以降低,说明氮气既有氧化性又有还原性。
①N2与H2化合生成NH3: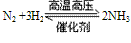
说明:该反应是一个可逆反应,是工业合成氨的原理。
②N2与金属反应(Mg Ca Sr Ba)反应: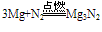
③N2与O2化合生成NO: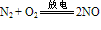
说明:在闪电或行驶的汽车引擎中会发生以上反应。
氮气的用途:
①合成氨,制硝酸;
②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;
⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;
④保存粮食、水果等食品,以防止腐烂;
⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;
⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
磷在自然界中的存在:
自然界中没有游离态的磷,磷主要以磷酸盐的形式存在于矿石中。磷和氮一样,是构成蛋白质的成分之一。动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷,磷对维持生物体正常的生理机能起着重要的作用。
磷的物理性质:
磷的单质有多种同素异形体,其中常见的是白磷和红磷。白磷和红磷的主要性质如下表。
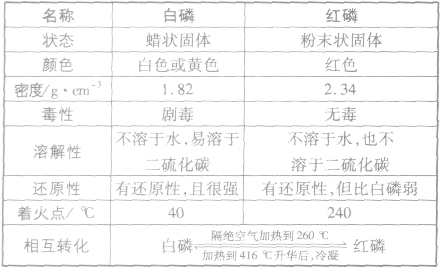
特别提醒白磷遇光会逐渐变为黄色。因此,白磷又称黄磷,白磷的颜色往往表述为“白色或黄色”。
白磷和红磷的化学性质:
白磷和红磷都能在空气或氧气中燃烧,燃烧产物一般是五氧化二磷,且反应放出大量的热,4P+5O2 2P2O5
2P2O5
磷的用途:
白磷和红磷有许多用途,如都可用于制造纯度较高的磷酸;白磷可用于制造燃烧弹、烟幕弹等;红磷可用于制农药、安全火柴等。
白磷和红磷的分子结构:
白磷的分子组成为P4,分子的空间构型为正四面体(如图A)。红磷的结构较复杂,有人认为红磷是P4分子断裂一个键后相互结合形成的长链状分子(如图B).
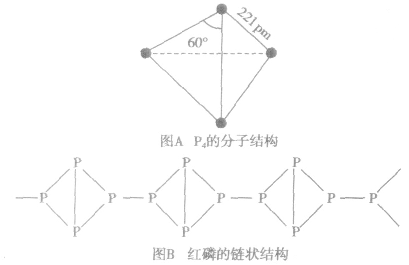
特别提醒白磷和红磷的化学式通常都写为P。
磷的化合物:
(1)五氧化二磷:
五氧化二磷的分子式为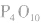 ,通常写为
,通常写为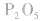 ,
,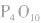 分子的空间构型如图所示。
分子的空间构型如图所示。
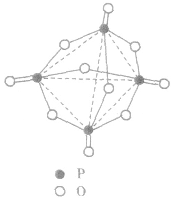
五氧化二磷通常为白色固体,由磷在空气中燃烧生成, 632K时升华。
五氧化二磷是典型的酸性氧化物,具有酸性氧化物的通性。
五氧化二磷很易跟水反应,跟冷水反应生成偏磷酸,跟热水反应生成磷酸,反应放出大量的热。
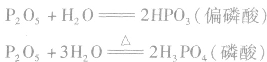
五氧化二磷的强亲水性决定了它可用作干燥剂。五氧化二磷是一种固态、酸性、无强氧化性的干燥剂,干燥能力非常强。
(2)磷酸:
磷酸为三元中强酸,属于弱电解质,易溶于水,在水中分三级电离。
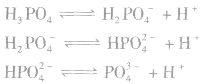
纯磷酸是无色晶体,熔点为315K.沸点较高,可溶于水。
磷酸无强氧化性,具有酸的通性。为了避免Br-、 I-被氧化,可用浓磷酸代替浓硫酸在实验室中制备HBr和HI。
(3)磷酸盐:
磷酸是三元酸,对应的盐有正盐和酸式盐: 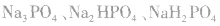 .
.