本试题 “过氧化氢(H2O2,氧的化合价为-1价),其水溶液俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤 口,采矿业用它作为废液的消毒剂(如消除氰化物KCN污染)。...” 主要考查您对氧化剂、还原剂
过氧化氢
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 过氧化氢
氧化剂:
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 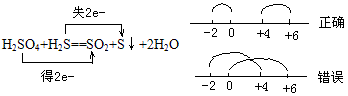
过氧化氢:
俗称,双氧水,基本结构为H-O-O-H,但并不是直线结构,因此有极性,是极性分子;O上有孤电子对,因此O-O键很弱易断。
过氧化氢和水的性质比较:


发现相似题
与“过氧化氢(H2O2,氧的化合价为-1价),其水溶液俗称双氧水,...”考查相似的试题有:
- 氮化铝(AIN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下...
- 工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示请回答:(1)NO2与H2O反应中的还原剂是______...
- 下列比值为2∶1的是[ ]A.pH=2与pH=1的硝酸中c(H+)之比B.Na2CO3溶液中c(Na+)与c(CO32-)之比C.0.2mol/L与0.1mol/L醋酸中c(H...
- 近几年来各地工地屡次发生误食NaNO2使人中毒的事件。因为NaNO2外观像食盐也有咸味,被不法商贩当作食盐贩卖,误食会引起中毒...
- 氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2...
- 单质X和Y相互反应生成化合物X2+Y2-。有下列叙述:①X被氧化;②X是氧化剂;③X具有氧化性;④XY既是氧化产物也是还原产物;⑤XY中...
- 下列变化需加入氧化剂才能实现的是[ ]A.Fe3+→Fe2+B.CuO→CuC.Cl-→Cl2D.H2SO4→BaSO4
- 某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。下列说法不正确的是[ ]A.若反应过程中转移了0.3 mol电子...
- 在下列反应中,水既不作氧化剂又不作还原剂的氧化还原反应是[ ]A.B.C.D.
- 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。请回答下列问题:⑴能用作干燥氨气的装置...