本试题 “(1)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的化学方程式_________________________(2)明矾是一种无色晶体,...” 主要考查您对其他钠盐(氯化钠、硫化钠、氮化钠等)
氢氧化铝
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 其他钠盐(氯化钠、硫化钠、氮化钠等)
- 氢氧化铝
其他的常见钠盐:
(1)氯化钠:与硝酸银反应:Cl-+Ag+==AgCl↓
工业上--制碱、生活中--食用、医用上--生理盐水氯化钠(NaCl)
用途:可用于食品调味和腌鱼肉蔬菜;制造氯气、氢气、盐酸、氢氧化钠、氯酸盐、次氯酸盐、漂白粉、金属钠,以及供盐析肥皂和鞣制皮革等。经高度精制的NaCl可用来制造生理盐水等。广泛用于临订治疗和生理实验,如失钠、失水、失血等情况。自然界中有盐矿,大量存在于海水和盐湖中。性质:式量58.44。食盐的主要成份。常见的有白色立方晶体或细小的结晶粉末。密度2.165克/厘米3。熔点801℃。沸点1413℃。味咸。溶于水,显中性。由浓缩海水结晶而制得,也可从天然的盐湖或盐井水制取。
(2)硫化钠:
①硫化钠遇酸反应,产生硫化氢。水溶液呈强碱性,故又称硫化碱。溶于硫黄生成多硫化钠。工业品因含杂质常为粉红、棕红色、土黄色块。有腐蚀性,有毒。在空气中易氧化生成硫代硫酸钠。
②硫化钠吸湿性很强,在100g水中的溶解度为15.4g(10℃),57.3g(90℃)。微溶于乙醇,不溶于乙醚。
③贮存方法:应放置通风、干燥处或石棉棚下。应防止雨淋和受潮。硫化碱潮解性大,又易氧化,容器必须密封。
(3)硫代硫酸钠:
①硫代硫酸钠,又名大苏打、海波,白色粉末,易溶于水。
②常用作照相定影剂
③是碘量法常用的还原剂
④与酸很容易歧化,生成气体和沉淀:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
钠的热点化合物:
叠氮酸钠(NaN3),类似于强碱弱酸盐。
氮化钠(Na3N),类盐,水解生成氢氧化钠和氨气,类似氮化镁、氮化钙、碳化钙等。
过硫化钠(Na2S2),具有类似过氧化钠的结构和化学性质。
高铁酸钠(Na2FeO4),具有强氧化性,还原产物为+3价铁的化合物。
氢氧化铝的性质:
不溶于水的白色胶状物质;能凝聚水中的悬浮物,可用作净水剂、可治疗胃酸过多、作糖的脱色剂等;既能与酸反应,又能与碱反应。
(1)与酸反应:Al(OH)3+3H+==Al3++3H2O
(2)与碱反应:Al(OH)3+OH-==AlO2-+2H2O
氢氧化铝的性质:
- 氢氧化铝是一种白色不溶于水的胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。
- 氢氧化铝既能与强酸反应也能与强碱反应,是两性氢氧化物。
- 氢氧化铝是医用的胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,是胃液酸度降低,起到中和过多胃酸的作用。
- 氢氧化铝受热是分解成氧化铝和水。2Al(OH)3=(加热)=Al2O3+3H2O
氢氧化铝的制备:
实验室制法:Al2(SO4)3+6NH3·H2O==(NH4)2SO4+Al(OH)3↓
其他制法:①AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
②2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
③AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
④3AlO2-+Al3++6H2O==4Al(OH)3↓
例题:用稀H2SO4、NaOH溶液和金属铝为原料制取Al(OH)3。
甲、乙、丙三个学生的制备途径分别是
甲:
乙: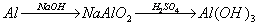
丙: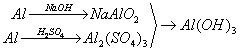
若要得到等量的Al(OH)3,则( B )
A.三者消耗的原料相同 B.甲消耗的原料的总物质的量最多 C.乙消耗的原料的总物质的量最少 D.丙消耗的原料的总物质的量最多
有关Al(OH)3的计算及图象分析:
解答有关Al(OH)3的图象和计算问题要注意以下三点:
(1)“铝三角”关系图中各物质转化方程式中的化学计量数关系。
(2)铝元素的存在形式。
(3)图象分析时:首先要看清横、纵坐标的含义,其次要对图象进行全面的分析,尤其需要关注的是特殊点(起点、折点、顶点、终点)的含义。
1、铝盐与强碱溶液作用生成Al(OH)3沉淀的计算
反应关系如下:
(1)Al3++3OH-==Al(OH)3(生成沉淀)
(2)Al(OH)3+OH-==AlO2-+2H2O(沉淀溶解)
(3)Al3++4OH-==AlO2-+2H2O(生成沉淀,又恰好溶解)
分析以上三个化学反应方程式,所得Al(OH)3沉淀的物质的量与n(Al3+)、n(OH-)的关系为:
当 ≤3时,所得沉淀的物质的量:n[Al(OH)3]=
≤3时,所得沉淀的物质的量:n[Al(OH)3]=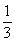 n(OH-)
n(OH-)
当 ≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
当3< <4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
<4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)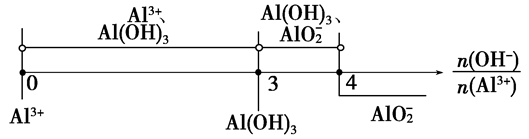
2、有关Al(OH)3的图像分析
①向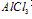 溶液中滴加
溶液中滴加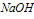 溶液
溶液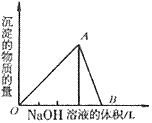
O~A段: 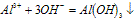
A~B段: 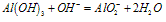
②向强碱溶液中滴入铝盐溶液 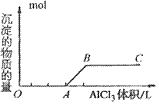
O~A段: 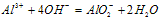
A~B段: 
③向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液
A. 向铝盐中滴加氨水时,当氨水增加到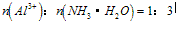 时,产生最大沉淀量
时,产生最大沉淀量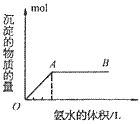
B. 向氨水中滴加铝盐溶液时,开始时氨水过量,如图所示 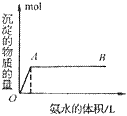
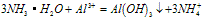
分析得:氢氧化铝不溶于弱碱氨水中。
④向偏铝酸盐溶液中滴入强酸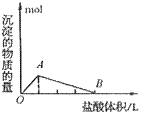
O~A段:
O~B段: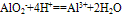
⑤向盐酸中滴加偏铝酸盐溶液 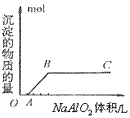
O~A段: 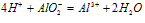
A~B段: 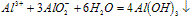
方法与技巧:
- 利用互滴顺序不同,现象不同可检验的溶液
(1)AlCl3溶液和盐酸
(2)NaAlO2溶液和盐酸
(3)Na2CO3溶液和盐酸
(4)AgNO3溶液和氨水 - 当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH4+、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,NaOH先与H+反应,再与Mg2+、Al3+反应生成沉淀,再与NH4+反应,最后才溶解Al(OH)3沉淀。一般是按生成水、沉淀、气体的顺序反应。可用图像表示为:
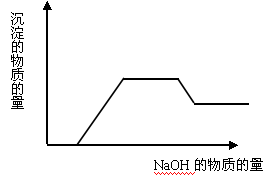
- AlO2-与HCO3-的反应不属于水解相互促进的反应,而是HCO3-电离出的H+与AlO2-发生的反应:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
与“(1)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO4...”考查相似的试题有:
- 下列物质中既能与NaOH溶液反应,又能与盐酸反应产生氢气是 ( )A. MgB. Cl2C. SiD.Al
- 将小块金属钠投入滴有酚酞的水中,不可能出现的现象是 ( )A.钠浮在水面上B.熔化成一个小球C.产生沉淀D.溶液变红
- 现有一块金属钠露置于空气中一段时间,为检验该固体是否部分变质为碳酸钠,先将固体样品溶解于水得到溶液,并采取下列措施,...
- (14分)过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为:2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O 某过碳酸钠样品中含有少量过氧...
- 一块表面被氧化的钠质量是8.5g,投入到水中,完全反应得到标准状况下的H2 0.1g,则原钠块中被氧化的钠的质量是A.2.3gB.4.6g...
- “神舟号”载人航天器中宇航员所在的轨道和返回仓都是密封的,宇航员吸入氧气、呼出二氧化碳,如果二氧化碳浓度过高,会使宇航...
- 下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是 ( )A.Na和O2 B.NaOH和CO2C.NaHCO3和NaOHD.Na2...
- 胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。(1)三硅酸镁的氧化物形式为_____________。(2)某金属...
- 下列说法合理的是( )A.既能与酸反应又能与碱反应的物质一定是两性物质B.焰色反应属于元素的物理性质C.物质的氧化性就是...
- 既能与盐酸反应,又能与NaOH溶液反应的是[ ]①Na2SiO3②Al(OH)3③SiO2④Al2O3⑤NaHCO3A.①②④B.②④⑤C.②③④D.全部