本试题 “下列说法正确的是[ ]A.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物B.利用化学方法,我们可以制造出新的分子,也能制造出新的原子C.将S...” 主要考查您对物质的简单分类
硅酸盐
二氧化硫
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的简单分类
- 硅酸盐
- 二氧化硫
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
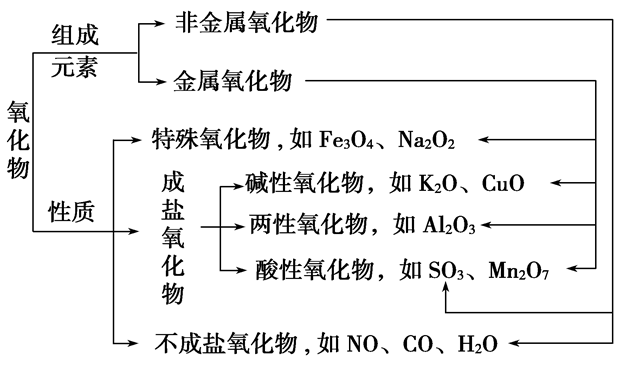
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:

氧化物的分类:
①硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用二氧化硅和金属氧化物的形式表示。例如:硅酸钠Na2SiO3(Na2O·SiO2);镁橄榄石Mg2SiO4(2MgO·SiO2);高岭石Al2(Si2O5)(OH)4(Al2O3·2SiO2·2H2O)
②云母、滑石、石棉、高岭石等,它们都属于天然的硅酸盐。
③人造硅酸盐:主要有玻璃、水泥、各种陶瓷、砖瓦、耐火砖、水玻璃以及某些分子筛等。
④硅酸盐制品性质稳定,熔点较高,难溶于水,有很广泛的用途。最简单硅酸盐是硅酸钠,其水溶液俗称水玻璃,是一种矿物胶,可作粘合剂,防腐剂。
硅酸钠:
(1)化学式:Na2SiO3
(2)俗称:其水溶液俗称水玻璃
(3)物理性质:硅酸钠溶液是无色黏稠液体
(4)化学性质:
①与盐酸反应 Na2SiO3+2HCl==== 2NaCl+H2SiO3(胶体)
②与CO2反应 NaSiO3+CO2+H2O ==Na2CO3+H2SiO3↓
③与水发生水解反应硅酸钠溶液显碱性
(5)制备:SiO2+2NaOH== Na2SiO3+H2O
(6)保存:试剂瓶不能配磨口玻璃塞
(7)用途:常用于制备硅胶和木材防火剂等
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


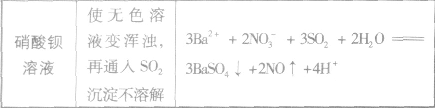
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表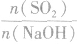 ,如下数轴所示:
,如下数轴所示: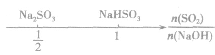
分析数轴可得:
(1)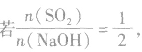 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)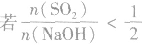 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)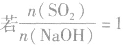 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)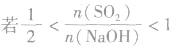 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)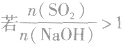 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
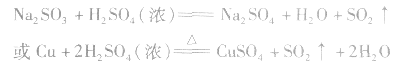
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

与“下列说法正确的是[ ]A.某物质经科学测定只含有一种元素,则...”考查相似的试题有:
- 下列关于有机物的叙述正确的是( )A.有机物都是非电解质B.熔点低的化合物都是有机物C.不含氢的化合物也可能是有机物D.含...
- 下表中物质的分类组合完全正确的是:编号ABCD强电解质HCl漂白粉Ba(OH)2纯碱弱电解质CH3COOHBaCO3HFHBr非电解质NH3CO2Cu蔗糖
- 某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④...
- 下列表述不正确的是[ ]A. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅B. 化学家采用玛瑙研钵摩擦固体反应物进...
- 下列关于硅的叙述正确的是( )A.硅是非金属元素,但是它的单质是灰黑色有金属光泽的固体B.硅的导电性能介于金属和绝缘体...
- 2012年3月13日,一艘运载7 000吨浓硫酸的韩国籍货船在汕尾海域发生自沉,船上18名外籍船员被救起。下列有关说法正确的是( )。...
- SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧Y形管中放置的药品组合不符合要求的是(必...
- 下列关于实验中颜色变化的叙述正确的是[ ]A.将二氧化硫通入品红溶液中,溶液显红色,加热后变为无色B.向溶液中加入新制氯水...
- 下列反应中,硫元素表现出氧化性的是A.稀硫酸与锌粒反应B.二氧化硫与氧气反应C.浓硫酸与碳反应D.三氧化硫与水反应
- 下列溶液能用来区别SO2和CO2气体的是A.石灰水B.酚酞溶液C.BaCl2溶液D.品红溶液