本试题 “最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下(1...” 主要考查您对原电池原理
化学与技术
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理
- 化学与技术
原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
化学技术在工农业生产有重要应用:
1.应用合成氨技术生产铵态氮肥,有利于农业生产;工业上生产磷肥、钾肥等。

2.接触法制硫酸,有利于工业生产。
(1)原料:主要有黄铁矿、硫黄等。
(2)原理:以黄铁矿为原料生产硫酸为例,生产主要经过三个阶段。
(3)有关反应

工业上并不直接用水吸收三氧化硫,而是用质量分数为98.3%的浓硫酸作吸收剂,因为三氧化硫与水蒸气容易形成酸雾,从而降低三氧化硫的吸收率。同时采用逆流吸收,硫酸从塔底放出。
3.工业上制取纯碱--联合之间法
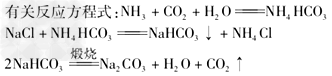
1.应用合成氨技术生产铵态氮肥,有利于农业生产;工业上生产磷肥、钾肥等。

2.接触法制硫酸,有利于工业生产。
(1)原料:主要有黄铁矿、硫黄等。
(2)原理:以黄铁矿为原料生产硫酸为例,生产主要经过三个阶段。
(3)有关反应

工业上并不直接用水吸收三氧化硫,而是用质量分数为98.3%的浓硫酸作吸收剂,因为三氧化硫与水蒸气容易形成酸雾,从而降低三氧化硫的吸收率。同时采用逆流吸收,硫酸从塔底放出。
3.工业上制取纯碱--联合之间法
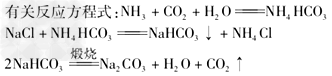
发现相似题
与“最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后...”考查相似的试题有:
- 某小组为研究电化学原理,设计如图装置。下列叙述不正确的是[ ]A.a和b用导线连接时,正极发生的反应:Cu2++2e- ==CuB.a和b...
- 某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2M...
- 下列关于原电池的叙述中,正确的是( )A.把电能转化为化学能,使溶液发生氧化还原反应B.电子从活泼金属流向不活泼金属,不...
- (Ⅰ)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.(1)以天然气为原料制H2是合成氨的一条重要的路线...
- 在下图的装置中,属于原电池的是( )A.B.C.D.
- 镍镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是Cd+2OH--2e-Cd(OH)2,2NiO(OH)+2H2O+2e-2Ni(OH)...
- 由铜、锌和稀盐酸组成的原电池中,铜是________极,发生________反应,电极反应式是________;锌是________极,发生________...
- 如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:(1)若两装置中均为CuSO4溶液,反应一段时间后:①有红色物...
- 一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+702+8KOH=4K2C03+10...
- 从能量转化的角度看,原电池是一种将_______转化为______的装置。组成一般原电池的三个基本条件是:① ___________,②________...