本试题 “用均为0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中 c (CH3COO-)>c (Na+),对该混合溶液的下列判断正确的是( )A.c (OH-)>c (H+)B.c ...” 主要考查您对弱电解质的电离
盐类水解判断溶液酸碱性或比较溶液pH值的大小
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质的电离
- 盐类水解判断溶液酸碱性或比较溶液pH值的大小
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: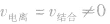 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
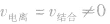 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
盐类水解原理的应用:
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
酸式盐溶液酸碱性的判断:
酸式盐的水溶液显什么性,要看该盐的组成微粒。
1.强酸的酸式盐只电离,不水解,溶液一定显酸性。如 溶液:
溶液: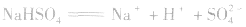
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液显碱性。例如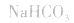 溶液中:
溶液中: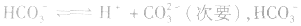
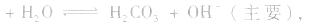
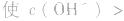
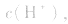 溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
(2)若电离程度大于水解程度,溶液显酸性。例如 溶液中:
溶液中: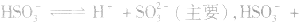
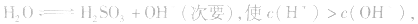 溶液显酸性
溶液显酸性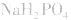 溶液亦显酸性。
溶液亦显酸性。
盐溶液蒸干后所得物质的判断:
1.考虑盐是否分解。如加热蒸干 溶液,因
溶液,因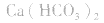 分解,所得固体应是
分解,所得固体应是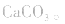
2.考虑氧化还原反应。如加热蒸干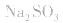 溶液,因
溶液,因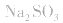 易被氧化,所得固体应是
易被氧化,所得固体应是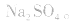
3.盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干 溶液,得
溶液,得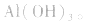 盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干
盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干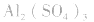 溶液,得
溶液,得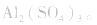
4.盐水解生成强碱时,蒸干后一般得到原物质,如蒸干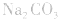 溶液,得到
溶液,得到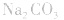 等。
等。
5.有时要多方面考虑,如加热蒸干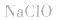 溶液时,既要考虑水解,又要考虑
溶液时,既要考虑水解,又要考虑 的分解,所得固体为
的分解,所得固体为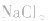
发现相似题
与“用均为0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中...”考查相似的试题有:
- 甲、乙两同学拟用实验确定某酸HA是弱电解质.他们的方案分别是:甲:①称取一定质量的HA配制0.1mol/L的溶液100mL;②用pH试纸测...
- 下列说法正确的是( )A.pH=2的溶液中的c(H+)是pH=4的溶液中的c(H+)的2倍B.等浓度的Na2CO3溶液的pH大于NaHCO3溶液的pHC...
- 常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。下列叙述中不正确的是A.常温下,pH相同的CH3CO...
- (1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋...
- 在醋酸的电离过程中,加入水会使下列比值增大的是( )A.c(CH3COOH)c(CH3COO-)B.c(CH3COO-)c(OH-)C.c(H+)c(CH3COOH)D.c(H...
- 甲酸(HCOOH)的下列性质中,可以证明它是弱电解质的是A.甲酸溶液中有大量的HCOOH分子和H+、HCOO—B.甲酸能与水以任意比例互...
- 下列说法不正确的是[ ]A.1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 LB.1 mol臭氧和1.5 mol氧气含有相...
- 下图中a、b、c、d分别表示常温下NH4Cl、H2SO4、NaOH、NH3·H2O四种溶液在稀释过程中pH变化的曲线,请回答下列问题(1)写出曲线a...
- 下列说法中不正确的是( )①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;②汽车尾气中含有能污染空...
- 分配系数是指弱电解质溶液中,溶质某种型体浓度与溶质型体总浓度的比值。分配曲线是指弱电解质溶液平衡状态时,每种型体浓度...