本试题 “T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得H2和CH3OH(g)的浓度随时间...” 主要考查您对化学反应的限度
化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应的限度
- 化学平衡的有关计算
化学反应的限度:
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
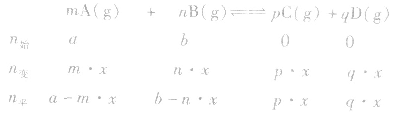
则有:

(2)对于反应物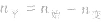 ,对于生成物
,对于生成物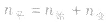
(3)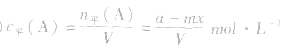
(4)A的转化率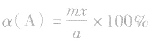
(5)平衡时A的体积(物质的量)分数
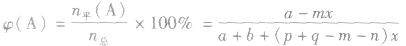
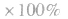
(6)
(7)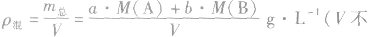
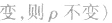
(8)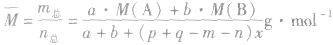
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
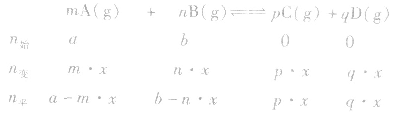
则有:

(2)对于反应物
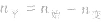 ,对于生成物
,对于生成物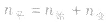
(3)
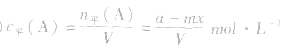
(4)A的转化率
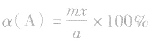
(5)平衡时A的体积(物质的量)分数
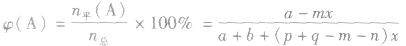
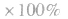
(6)

(7)
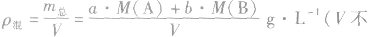
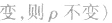
(8)
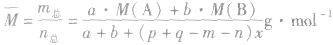
发现相似题
与“T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,一定条件下发...”考查相似的试题有:
- 某研究小组利用反应CO(g)+2H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同...
- 在一容积可变的密闭容器中,aA(气)bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60...
- t℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)xC(g),2 min时反应达...
- 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g)2NH3(g)(1)若反应进行到...
- 反应NH4HS(固)NH3(气)+H2S(气)在某温度下达到平衡,下列各种情况不能使平衡发生移动的是 A.移走一部分NH4HSB.其他条件不变...
- 如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和...
- 在一定温度下,两个恒容密闭容器中分别发生下列两个反应:①H2(g)+I2(g)2HI(g) ②C(s)+H2O(g)CO(g)+H2(g),下列状态能表明两...
- 在一定条件下,向1 L密闭容器中充入3 mol X 气体和1 mol Y气体,发生反应2X(g)+2Y(g)3Z(g)+2W(g),达到化学平衡时,测出的...
- 向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同温度下,发生反应:A(g)+B(g)xC(g) △H<0测...
- 一定条件下,将A、B、C三种物质各1 mol通入一个密闭容器中发生反应:2A+B2C,达到化学反应限度时,B的物质的量可能是( )。A.1.5 m...