本试题 “工业上通常把溶液中存在的CO32-和HCO3-的总浓度称为总碱度。水中碱度的控制成为碳酸钠软化水处理 法的关键。碳酸在水中一般以3种形态存在,即H2CO3(CO2)、CO3...” 主要考查您对溶液的酸碱性
粒子浓度大小的比较
溶度积常数
物质的量的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶液的酸碱性
- 粒子浓度大小的比较
- 溶度积常数
- 物质的量的有关计算
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
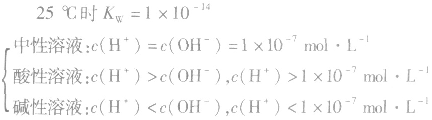
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
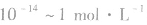 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: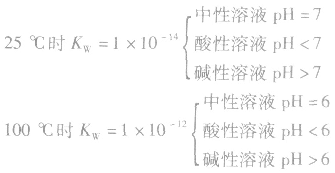
离子浓度大小比较方法:
(1)考虑水解因素:如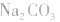 溶液
溶液 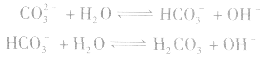
所以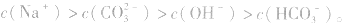
(2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的
 三种溶液中,
三种溶液中, 由大到小的顺序是c>a>b。
由大到小的顺序是c>a>b。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素。如相同浓度的 的混合液中,离子浓度顺序为:
的混合液中,离子浓度顺序为: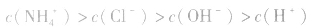
 的电离程度大于
的电离程度大于 的水解程度。
的水解程度。
盐溶液的“三大守恒”:
①电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:
推出: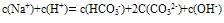
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nc(Na+):nc(C)=1:1,
推出: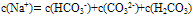
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系: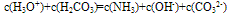
(2)粒子浓度大小比较的方法:
①单一溶液中离子浓度大小的比较
A. 一元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
如:在CH3COONa溶液中各离子浓度大小关系: 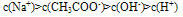
B. 二元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)> c(二级水解离子)>c(水电离出的另一离子)
如:Na2CO3溶液中离子浓度的关系: 
②比较不同电解质溶液中同一种粒子浓度的大小。应注意弱酸、弱碱电离程度的大小以及影响电离度的因素,盐类水解及水解程度对该粒子浓度的影响。
③比较经过反应化学反应后离子浓度的大小:
A. 确定电解质溶液的成分
B. 确定溶液中含哪些粒子(分子、离子),此时要考虑物质的电离和水解情况
C. 确定各种粒子的浓度或物质的量的大小
D. 根据题目要求做出判断
注:要抓住“两小”。即弱电解质电离程度小,故未电离的弱电解质分子数远多于已电离出离子数目;盐的水解程度小,故未水解的粒子数目远多于水解生成的粒子数目
在AgCl(s)
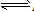 Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示
Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示(1)溶度积的通式:
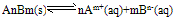 ,
,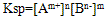
(2)溶度积规律:
①离子积:
 ,
,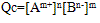
Qc为离子积,表达式中离子浓度是任意的,为此瞬间溶液的实际浓度,其值不确定,但对一难溶电解质,在一定温度下,Ksp为一定值。
②溶度积规则:
A. 当Qc>Ksp时,沉淀从溶液中析出来,体系不断析出沉淀,直至达到平衡(此时Qc=Ksp)
B. 当Qc=Ksp时,沉淀于饱和溶液平衡
C. 当Qc<Ksp时,溶液不饱和,若体系中有沉淀,则沉淀会溶解直至平衡(此时Qc=Ksp)。
计算物质的量浓度时应注意的问题:
物质的量浓度是表示溶液组成的一个重要物理量,是高中化学的重要内容之一。应用时要注意以下几方面的问题:
1.注意溶质是什么
对有些特殊情况要注意辨别,不能出错。如SO2、CuSO4·5H2O等溶于水后所得溶液中的溶质分别为 H2SO4和CuSO4,进行有关氨水的浓度计算时以NH3 为溶质来计算等。
2.注意溶液的体积
主要注意两点:一是不能用水的体积代替溶液的体积;二是当题设未给溶液密度时,可将各溶液(一般为稀溶液)的体积相加(如溶液混合、稀释),认为其和为溶液的总体积;当给出密度时,则需通过密度求溶液的最终体积。
3.注意单位运算
在概念理解及应用中,要注意各物理量的单位.一是各物理量的单位要相互匹配,二是从单位运算人手.能简化解题思路,快速求解。
4.注意溶解度的影响
第一,物质的量浓度适用于表示不饱和及饱和溶液中溶质与溶剂的关系,不适用于过饱和溶液(溶质未溶解完全);
第二,注意一些典型问题,如Ca(OH)2的溶解度随温度变化情况及气体物质在溶剂中的溶解问题等。
5.注意密度变化规律
在溶液混合和溶液稀释等问题中,在注意溶液体积变化的同时,还要考虑溶液密度的变化对溶质物质的量浓度的影响。如强酸、强碱、盐等溶液的密度随浓度增大而增大;氨水、乙醇等溶液的密度随浓度增大而减小。
6.注意实验情景
在计算溶液配制或溶液稀释等问题中物质的量浓度时,一要注意不能把水的体积当作溶液的体积;二是配制溶液时,要注意容量瓶规格与所需溶液体积的关系。因容量瓶的规格是固定的,所以选用的容量瓶的规格要等于或略大于所需溶液的体积。
7.注意物质与其组成粒子的关系
物质与其组成粒子的物质的量、物质的量浓度之间的关系可以通过电离方程式进行分析。如Na2SO4 溶液中c(Na+)=2c(SO42-)=2c(Na2SO4)。
以物质的量为核心的演绎公式:
1.溶液稀释定律
(1)对于已知质量分数溶液的稀释:稀释前后溶质的质量不变,即: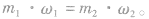
(2)对于已知物质的量浓度溶液的稀释:稀释前后溶质的物质的量不变,即: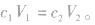
2.物质的量浓度与溶质质量分数的换算
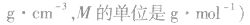
3.溶解度S与溶质质量分数ω的换算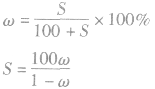
4.溶解度与饱和溶液物质的量浓度的换算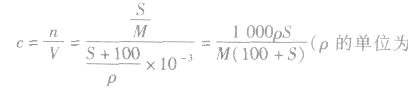

5.标准状况下气体溶于水后所得溶液的物质的量浓度的计算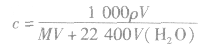
式中V为标准状况下气体的体积(L),V(H2O)为水的体积(L),ρ为溶液的密度(g·cm-3)。
6.相对密度(D)的计算及意义两种气体在同温同压下的密度之比即为相对密度,显然,它等于相对分子质量(或摩尔质量)之比,即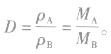
与“工业上通常把溶液中存在的CO32-和HCO3-的总浓度称为总碱度。...”考查相似的试题有:
- 保健医生提示:胃酸过多的人,应少食苹果,那么苹果汁的PH[ ]A.大于7B.等于7C.小于7D.无法判断
- 下列溶液中微粒的物质的量浓度关系正确的是( )A.氯水中:c(Cl2)═2[c(ClO-)+c(Cl-)+c(HClO)]B.Na2CO3溶液:c(OH-...
- 已知酸式盐NaHB在水溶液中存在下列反应: ①NaHB==Na++HB-,②HB-H++B2-,③HB-+H2OH2B+OH-且溶液中c(H+)>c(OH-),则下列说法...
- 用0.1mol•L-1的氢氧化钠滴定0.10mol•L-1的醋酸,滴定过程中不可能出现的结果是( ) A.c(Na+)>c(CH3COO-),c(OH-)>c...
- 室温下,下列各项中的比值为2:1的是[ ]A.0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比B.(NH4)2SO4溶液中c(NH4+)和c(SO...
- 在20mL 0.l0mol•L-1HCl溶液中逐滴加入0.20mol•L-1氨水,容液pH和加入的氨水的体积关系曲线如右图所示,有关微粒浓度大小关系...
- 把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mo...
- 用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下)。再往反应...
- 将112mL(标况)乙炔气体溶于2mL苯中,再加入30g苯乙烯,所得混合物含碳量为( )A.75%B.66.7%C.92.3%D.无法计算
- 顺式Pt(NH3)2Cl2(相对分子质量为300)是临床广泛使用的抗肿瘤药物.下列有关该物质的说法中正确的是( )A.由4种元素组成...