本试题 “某校化学实验室废油桶中收集了溶有大量FeSO4、CuSO4的废液,此外还有一些不溶性杂质.若废液直接排放到下水道不仅造成重金属污染,而且造成浪费.该校化学兴...” 主要考查您对常用仪器的名称和选用
化学反应方程式的书写
金属活动性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 常用仪器的名称和选用
- 化学反应方程式的书写
- 金属活动性
常用的实验仪器:
试管、烧杯、蒸发皿、坩埚、酒精灯、漏斗、洗气瓶、干燥管、
托盘天平、量筒、容量瓶、滴定管、玻璃棒、量气装置等。
常用仪器对比分析:
试管、烧杯、蒸发皿、坩埚、酒精灯、漏斗、洗气瓶、干燥管、
托盘天平、量筒、容量瓶、滴定管、玻璃棒、量气装置等。
常用仪器对比分析:
|
常见的化学仪器 |
主要用途 | ||
|
分类 |
名称 |
图示 | |
| 用于加热仪器 | 试管 |  |
(1)用作少量试剂的反应容器,在常温或加热时使用 (2)作为小型气体发生器 (3)收集少量气体 |
| 蒸发皿 |  |
用于溶液的蒸发、浓缩 | |
| 燃烧匙 |  |
用于盛放可燃性固体物质进行燃烧实验 | |
| 烧杯 |  |
(1)溶解物质配制溶液 (2)较大量试剂反应容器 (3)常温或加热使用 | |
| 锥形瓶,烧瓶(圆底,平底) | 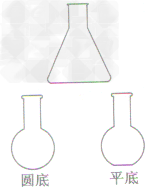 |
(1)用作较大量液体反应的容器和气体发生装置,在常温或加热时使用 (2)锥形瓶是蒸馏的接收容器 | |
| 酒精灯 | 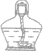 |
用于加热 | |
| 盛放物质的仪器 | 集气瓶 |  |
(1)收集和储存少量气体 (2)进行物质和气体之间的反应 |
| 滴瓶,滴管 | 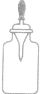 |
滴瓶用于盛放少量液体试剂 | |
| 细口瓶 | 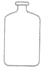 |
储存液体药品 | |
| 广口瓶 |  |
储存固体药品 | |
| 计量仪器 | 托盘天平 | 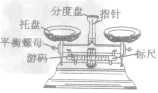 |
称量物质的质量(精确度为0.1g) |
| 量筒 |  |
量取一定体积的液体或间接测量气体的体积 | |
| 漏斗 | 普通漏斗 |  |
过滤,注入液体 |
| 长颈漏斗 |  |
用于注入液体 | |
| 分液漏斗 |  |
(1)注入液体 (2)分液漏斗用于分离两种密度不同且互不相溶的液体 | |
| 夹持仪器 | 铁架台 |  |
固定和放置各种仪器 |
| 试管夹 |  |
夹持试管进行简单的加热试验 | |
| 坩埚钳 |  |
夹持坩埚或夹持热的蒸发皿等 | |
| 辅助仪器 | 水槽 |  |
排水集气 |
| 药匙 |  |
取用固体药品(粉末状或小颗粒状) | |
| 玻璃棒 |  |
搅拌液体,引流,沾取液体 | |
| 石棉网 |  |
用于烧杯或烧瓶加热时垫在底部,使仪器受热均匀 | |
| 试管刷 |  |
用于刷洗试管等玻璃仪器 | |
| 温度计 |  |
用于测量温度 | |
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
定义:
金属活动性指金属单质在水溶液中失去电子生成金属阳离子的性质。
常见金属活动性顺序:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属活动性顺序表的意义
(1)金属的位置越靠前,它的活动性越强
(2)位于氢前面的金属能置换出酸中的氢(强氧化酸除外)。
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。
(4)很活泼的金属,如K、Ca、Na与盐溶液反应,先与溶液中的水反应生成碱,碱再与盐溶液反应,没有金属单质生成。如:
2Na+CuSO4+2H2O==Cu(OH)2↓+Na2SO4+H2↑
(5)不能用金属活动性顺序去说明非水溶液中的置换反应,如氢气在加热条件下置换氧化铁中的铁:
Fe2O3+3H2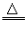 2Fe+3H2O
2Fe+3H2O
金属原子与金属离子得失电子能力的比较

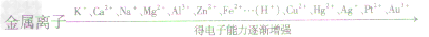
金属活动性顺序表的应用
(1)判断某些置换反应能否发生
a.判断金属与酸能否反应:
条件:
①金属必须排在氢前面
②酸一般指盐酸或稀硫酸
b.判断金属与盐溶液能否反应:
条件:
①单质必须排在盐中金属的前面
②盐必须可溶于水
③金属不包含K、Ca、Na
(2)根据金属与盐溶液的反应判断滤液、滤渣的成分。如向CuSO4,AgNO3混合液中加铁粉,反应后过滤,判断滤液和滤渣成分。铁与CuSO4和AgNO3溶液反应有先后顺序,如果铁足量,先将AgNO3中的Ag完全置换后再置换CuSO4中的Cu,那么溶液中只有FeSO4;如果铁的量不足,应按照“先后原则”分别讨论滤液和滤渣的成分。
(3)根据金属活动性顺序表判断金属与酸反应的速率或根据反应速率判断金属的活动性顺序。如镁、锌、铁三种金属与同浓度的稀H2SO4反应产生氢气的速率:Mg>Zn>Fe,则可判断金属活动性Mg>Zn>Fe,
(4)利用金属活动性顺序表研究金属冶炼的历史。金属活动性越弱,从其矿物中还原出金属单质越容易; 金属活动性越强,从其矿物中还原出金属单质越难。所以越活泼的金属越不易冶炼,难于冶炼的金属开发利用的时间就越迟。
(5)应用举例
a.湿法炼铜我国劳动人民在宋代就掌握了湿法炼铜技术,即将铁放入硫酸铜溶液中置换出铜: Fe+CuSO4=FeSO4+Cu。
b.从洗相废液中回收银洗相废掖中含有大量的硝酸银,可用铁置换回收: Fe+2AgNO3==Fe(NO3)2+2Ag。
c.处理工业废水中的铜、汞离子工业废水中常含铜、汞等金属离子,这些离子对生物有很大的危害,在排放前必须进行处理,可用铁置换回收:Fe+CuSO4==FeSO4+Cu
d.实验室选择金属与酸反应制取氢气在金属活动性顺序表中,H之前的金属都能跟稀 H2SO4、稀HCl反应产生氢气,但Zn之前的金属与酸反应太快。不便操作;Zn之后的金属与酸反应太慢,花费时间太长,从经济效益和反应速率多方而考虑,Zn是最合适的金属。
金属与混合溶液的反应
(1)将一种金属单质放入几种金属的盐溶液的混合液中时,其中排在金属活动性顺序表巾最靠后的金属最先被置换出来,然后再依次置换出稍靠后的金属。简记为“在金属活动性顺序中,距离远,先反应”。如将金属Zn。放入FeSO4和CuSO4的混合溶液中,Zn先与CuSO4发生置换反应,与CuSO4反应完后再与FeSO4 发生置换反应。根据金属锌的最不同可分为以下几种情况:
(2)将几种不同的金属放入同一种盐溶液中,发生反应的情况与将一种金属放入几种金属的盐溶液中相似,也是在金属活动性顺序表中,距离越远的先反应,然后是距离较远的反应。
金属与酸反应生成氢气图像问题的分析方法:
(1)等质氢图:两种金属反应产生的氢气质量相同,此图反映两种情况:

①酸不足,金属过虽,产生的氢气质量由酸的质量决定。
②酸足量,投放的两种金属与酸反应产生氢气的质量恰好相同,如6.5g锌和5.6g铁分别投入足量的盐酸中反应产生的氢气质量相同。
(2)等质等价金属图:如等质量的镁、铁、锌与足量的酸反应生成的金属离子都是+2价,产生氢气的速率和质量不同。此图反映出:

①金属越活泼,图示反应物的线越陡,如Mg线比Zn线陡,Zn线比Fe线陡,说明活泼性Mg>Zn>Fe
②金属的相对原子质量越小。等质量时,与酸反应产生的氢气越多,曲线的拐点越高,因此,相对原子质量Zn >Fe>Mg。
可简单概括为:越陡越活,越高越小。
(3)等质不等价金属图:铝、镁、锌与酸反应生成金属离子的化合价分别为+3、+2、+2,此图反映出等质不等价金属与酸反应不仅速率不同而且生成的氢气的质量与金属化合价有关。
可用下面式子计算氢气质量:

金属与酸或盐溶液反应前后溶液密度变化的判断方法:
金属与酸的反应和金属与盐溶液的反应均为置换反应,反应后溶液的溶质发生了改变,导致溶液的溶质质量分数、溶液的密度也随之改变。反应前后溶液的密度的变化取决于反应前后溶液中溶质的相对分子质量的相对大小。
(1)反应后溶液密度变小:如Fe+CuSO4== FeSO4+Cu,在该反应中,反应前溶液中的溶质为CuSO4,其相对分子质量为160;反应后溶液中的溶质为FeSO4,其相对分子质量为152,由于152<160,故该反应后溶液密度变小。
(2)反应后溶液密度变大:如Zn+H2SO4== ZnSO4+H2↑,在该反应中,反应前溶液中的溶质为H2SO4,相对分子质量为98;反应后溶液中溶质为ZnSO4,相对分子质童为161,由于161>98。故该反应后溶液密度变大。
真假黄金的鉴别:
黄金是一种具有金黄色光泽的金属、化学性质极不活泼。黄铜的外形与黄金非常相似,所以不法分子常用黄铜(Zn,Cu合金)来冒充黄金。但二者之间的性质有很大差异,可用多种方法鉴别。
方法一:取少量金黄色金属块于试管中,加入少量稀盐酸或稀硫酸,若有气泡产生(Zn+2HCl==ZnCl2 +H2),则原试样为黄铜;若没有气泡产生,则原试样为黄金。
方法二:取少量金黄色金属块,用天平称其质量,用量筒和水测出其体积,计算出金属块的密度与黄金的密度对照,若密度相等,则为黄金;若有较大的差异,则为黄铜。
方法三:取少员金黄色金属块在火焰上加热,若金属块表面变黑(2Cu+O2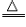 2CuO,则原试样为黄铜;若无变化,则为黄金。
2CuO,则原试样为黄铜;若无变化,则为黄金。
方法四:取少讨金黄色金属块于试管中,向试管中加人适量的硫酸铜溶液,若金属块表而出现红色物质且溶液颜色变浅(Zn+CuSO4==ZnSO4+Cu),则原试样为黄铜;若无变化,则原试样为黄金。
金属活动性指金属单质在水溶液中失去电子生成金属阳离子的性质。
常见金属活动性顺序:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属活动性顺序表的意义
(1)金属的位置越靠前,它的活动性越强
(2)位于氢前面的金属能置换出酸中的氢(强氧化酸除外)。
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。
(4)很活泼的金属,如K、Ca、Na与盐溶液反应,先与溶液中的水反应生成碱,碱再与盐溶液反应,没有金属单质生成。如:
2Na+CuSO4+2H2O==Cu(OH)2↓+Na2SO4+H2↑
(5)不能用金属活动性顺序去说明非水溶液中的置换反应,如氢气在加热条件下置换氧化铁中的铁:
Fe2O3+3H2
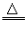 2Fe+3H2O
2Fe+3H2O金属原子与金属离子得失电子能力的比较

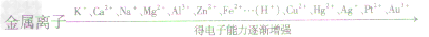
金属活动性顺序表的应用
(1)判断某些置换反应能否发生
a.判断金属与酸能否反应:
条件:
①金属必须排在氢前面
②酸一般指盐酸或稀硫酸
b.判断金属与盐溶液能否反应:
条件:
①单质必须排在盐中金属的前面
②盐必须可溶于水
③金属不包含K、Ca、Na
(2)根据金属与盐溶液的反应判断滤液、滤渣的成分。如向CuSO4,AgNO3混合液中加铁粉,反应后过滤,判断滤液和滤渣成分。铁与CuSO4和AgNO3溶液反应有先后顺序,如果铁足量,先将AgNO3中的Ag完全置换后再置换CuSO4中的Cu,那么溶液中只有FeSO4;如果铁的量不足,应按照“先后原则”分别讨论滤液和滤渣的成分。
(3)根据金属活动性顺序表判断金属与酸反应的速率或根据反应速率判断金属的活动性顺序。如镁、锌、铁三种金属与同浓度的稀H2SO4反应产生氢气的速率:Mg>Zn>Fe,则可判断金属活动性Mg>Zn>Fe,
(4)利用金属活动性顺序表研究金属冶炼的历史。金属活动性越弱,从其矿物中还原出金属单质越容易; 金属活动性越强,从其矿物中还原出金属单质越难。所以越活泼的金属越不易冶炼,难于冶炼的金属开发利用的时间就越迟。
(5)应用举例
a.湿法炼铜我国劳动人民在宋代就掌握了湿法炼铜技术,即将铁放入硫酸铜溶液中置换出铜: Fe+CuSO4=FeSO4+Cu。
b.从洗相废液中回收银洗相废掖中含有大量的硝酸银,可用铁置换回收: Fe+2AgNO3==Fe(NO3)2+2Ag。
c.处理工业废水中的铜、汞离子工业废水中常含铜、汞等金属离子,这些离子对生物有很大的危害,在排放前必须进行处理,可用铁置换回收:Fe+CuSO4==FeSO4+Cu
d.实验室选择金属与酸反应制取氢气在金属活动性顺序表中,H之前的金属都能跟稀 H2SO4、稀HCl反应产生氢气,但Zn之前的金属与酸反应太快。不便操作;Zn之后的金属与酸反应太慢,花费时间太长,从经济效益和反应速率多方而考虑,Zn是最合适的金属。
金属与混合溶液的反应
(1)将一种金属单质放入几种金属的盐溶液的混合液中时,其中排在金属活动性顺序表巾最靠后的金属最先被置换出来,然后再依次置换出稍靠后的金属。简记为“在金属活动性顺序中,距离远,先反应”。如将金属Zn。放入FeSO4和CuSO4的混合溶液中,Zn先与CuSO4发生置换反应,与CuSO4反应完后再与FeSO4 发生置换反应。根据金属锌的最不同可分为以下几种情况:
| 金属锌的量 | 析出金属 | 滤液的成分 |
| 锌不足(不能与CuSO4溶液完全反应) | Cu | ZnSO4、FeSO4、CuSO4 |
| 锌不足(恰好与CuSO4溶液完全反应) | Cu | ZnSO4、FeSO4 |
| 锌不足(不能与FeSO4溶液完全反应) | Fe、Cu | ZnSO4、FeSO4 |
| 锌适量(恰好与FeSO4溶液完全反应) | Fe、Cu | ZnSO4 |
| 锌足量 | Zn、Fe、Cu | ZnSO4 |
金属与酸反应生成氢气图像问题的分析方法:
(1)等质氢图:两种金属反应产生的氢气质量相同,此图反映两种情况:

①酸不足,金属过虽,产生的氢气质量由酸的质量决定。
②酸足量,投放的两种金属与酸反应产生氢气的质量恰好相同,如6.5g锌和5.6g铁分别投入足量的盐酸中反应产生的氢气质量相同。
(2)等质等价金属图:如等质量的镁、铁、锌与足量的酸反应生成的金属离子都是+2价,产生氢气的速率和质量不同。此图反映出:

①金属越活泼,图示反应物的线越陡,如Mg线比Zn线陡,Zn线比Fe线陡,说明活泼性Mg>Zn>Fe
②金属的相对原子质量越小。等质量时,与酸反应产生的氢气越多,曲线的拐点越高,因此,相对原子质量Zn >Fe>Mg。
可简单概括为:越陡越活,越高越小。
(3)等质不等价金属图:铝、镁、锌与酸反应生成金属离子的化合价分别为+3、+2、+2,此图反映出等质不等价金属与酸反应不仅速率不同而且生成的氢气的质量与金属化合价有关。
可用下面式子计算氢气质量:


金属与酸或盐溶液反应前后溶液密度变化的判断方法:
金属与酸的反应和金属与盐溶液的反应均为置换反应,反应后溶液的溶质发生了改变,导致溶液的溶质质量分数、溶液的密度也随之改变。反应前后溶液的密度的变化取决于反应前后溶液中溶质的相对分子质量的相对大小。
(1)反应后溶液密度变小:如Fe+CuSO4== FeSO4+Cu,在该反应中,反应前溶液中的溶质为CuSO4,其相对分子质量为160;反应后溶液中的溶质为FeSO4,其相对分子质量为152,由于152<160,故该反应后溶液密度变小。
(2)反应后溶液密度变大:如Zn+H2SO4== ZnSO4+H2↑,在该反应中,反应前溶液中的溶质为H2SO4,相对分子质量为98;反应后溶液中溶质为ZnSO4,相对分子质童为161,由于161>98。故该反应后溶液密度变大。
真假黄金的鉴别:
黄金是一种具有金黄色光泽的金属、化学性质极不活泼。黄铜的外形与黄金非常相似,所以不法分子常用黄铜(Zn,Cu合金)来冒充黄金。但二者之间的性质有很大差异,可用多种方法鉴别。
方法一:取少量金黄色金属块于试管中,加入少量稀盐酸或稀硫酸,若有气泡产生(Zn+2HCl==ZnCl2 +H2),则原试样为黄铜;若没有气泡产生,则原试样为黄金。
方法二:取少量金黄色金属块,用天平称其质量,用量筒和水测出其体积,计算出金属块的密度与黄金的密度对照,若密度相等,则为黄金;若有较大的差异,则为黄铜。
方法三:取少员金黄色金属块在火焰上加热,若金属块表面变黑(2Cu+O2
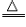 2CuO,则原试样为黄铜;若无变化,则为黄金。
2CuO,则原试样为黄铜;若无变化,则为黄金。方法四:取少讨金黄色金属块于试管中,向试管中加人适量的硫酸铜溶液,若金属块表而出现红色物质且溶液颜色变浅(Zn+CuSO4==ZnSO4+Cu),则原试样为黄铜;若无变化,则原试样为黄金。
发现相似题
与“某校化学实验室废油桶中收集了溶有大量FeSO4、CuSO4的废液,...”考查相似的试题有:
- 现有以下仪器,请回答下列问题:(1)仪器⑤的名称是______;取用粉末状固体必须用到的仪器是______(填序号).(2)如果用加...
- 化学是一门以实验为基础的学科,做化学实验需要实验仪器,我们必须认识仪器并学会正确使用仪器。 现有如下仪器:⑴ 用仪器名称...
- 写出下列仪器的名称:A______B______C______D______E______F______G______.
- 根据下列实验装置图,问答问题:(1)写出标有序号的仪器名称:①______,②______.(2)在实验室中用高锰酸钾制取氧气时,发...
- 小明同学用镁带燃烧的实验来探究质量守恒定律:(1)镁带在空气中燃烧的化学方程式为____________。(2)镁带完全燃烧后,小...
- 炼油厂常用氢氧化钠溶液洗涤石油产品中的残余硫酸,以达到精炼石油的目的.写出该反应的化学方程式:______,该化学反应的基...
- 下列化学方程式书写正确的是( )A.2H2+O2 点燃 . 2H2OB.4Fe+3O2 点燃 . 2Fe2O3C.Mg+O2 点燃 . MgOD.C+O2=CO2
- (3分)写出符合下列要求的物质(或主要成分)的化学式。(1)碘酒中的溶剂 ; (2)最简单的有机物 ;(3)不含金属元素的碱 。
- 下列化学方程式书写正确的是 A.CO + O2CO2B.2HgO =" 2Hg" + O2↑C.2H2O22H2O+O2↑D.NaOH + H2SO4= NaSO4+ H2O
- 金属R与CuSO4溶液中,有红色物质析出,放入ZnSO4溶液中无现象.则三种金属活动性由弱到强排列的是( )A.R、Zn、CuB.Cu、R...