本试题 “下列说法正确的是( )A.凡pH<7的雨水就可看作“酸雨”B.燃烧不一定要有氧气参加,但燃烧一定是氧化还原反应C.用NaClO溶液代替Cl2作为漂白剂是由于它难分解...” 主要考查您对氧化还原反应的本质和特征
氧化还原反应的定义
三氧化硫
合金
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的本质和特征
- 氧化还原反应的定义
- 三氧化硫
- 合金
电子的转移(得失或偏移)
氧化还原反应的特征:
化合价升降(某些元素化合价在反应前后发生变化,是氧化还原反应判别的依据)
氧化还原反应的发展史:
- 物质与氧气发生的反应属于氧化反应,含氧化合物中氧被夺去的反应属于还原反应。
- 有化合价升降的反应属于氧化还原反应。
- 有电子得失或偏移的反应属于氧化还原反应。
对物质的认识存在发展的过程,从最初的隔离开的氧化反应、还原反应,到从表面上看化合价变化的氧化还原反应,把氧化与还原统一在一个概念下,再透过现象看本质,化合价的变化是有电子得失或偏移引起的。
氧化还原反应中应注意的几个问题:
1、氧化剂氧化性的强弱,不是看得电子的多少,而是看得电子的难易;
还原剂还原性的强弱,不是看失电子的多少,而是看失电子的难易。
eg:氧化性:浓HNO3>稀HNO3还原性:Na>Al
2、有新单质参加或生成的反应不一定是氧化还原反应 eg:C(金刚石)==C(石墨);3O2==2O3(放电);P4(白磷)==4P(红磷)
3、任何元素在化学反应中,从游离态变为化合态,或由化合态变为游离态,均发生氧化还原反应(比如置换反应,化合反应,分解反应)
4、置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
5、元素具有最高价的化合物不一定具有强氧化性! eg.H3PO4、H2SiO3(或H4SiO4)两酸均无强氧化性但硝酸有强氧化性。
氧化还原的表示可用单线桥也可用双线桥:
一、双线桥法:
此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团。
标变价 明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
连双线 将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
标得失 1.标电子转移或偏离数 明确标出得失电子数,格式为“得/失发生氧化还原反应原子个数×单位原子得失电子数”
2.标化合价变化 一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
3.标出元素反应类型 一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒 检查得失电子数是否相等,如不相等则重新分析。
例如: 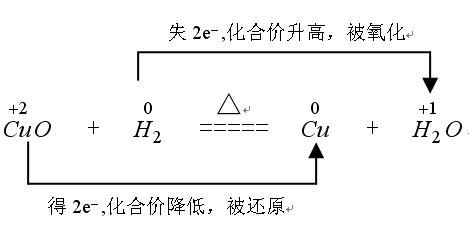
二、单线桥法:
在氧化还原反应中,有电子发生转移(得失或偏移),也就是在反应物中有元素电子发生得失或偏移,这时用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数,这种表示方法叫单线桥法。
(1)标价态明确标明发生氧化还原反应的元素的化合价
(2)连单线连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂
(3)不注得失标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数
例如: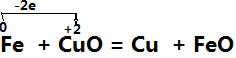
注意事项:
(1)不得标明"得"或"失",否则是错的
(2)箭头表示电子转移的方向,指向氧化剂注意:为了规范起见,单线桥法最好不用于自身氧化还原的反应,因为那样标记会使反应中的电子去向不明确,故在自身氧化还原的反应方程式中最好用双线桥法表示电子转移。
氧化还原反应:
有电子转移(得失或偏移)的反应;(无电子转移(得失或偏移)的反应为非氧化还原反应)
反应历程:
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
氧化还原反应中存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化还原性的强弱判定:
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
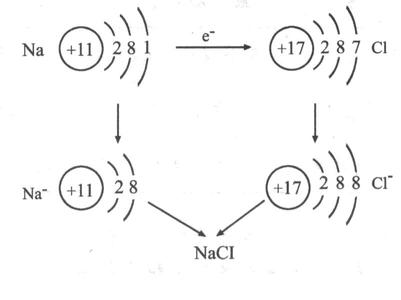
电子的得失过程:

其过程用核外电子排布变化情况可表示为:
三氧化硫:
分子式:SO3,是含极性键的非极性分子,固态时为分子晶体。
三氧化硫的物理性质和化学性质:
1.物理性质:无色易挥发的晶体,熔点为16.8℃,沸点为44.8℃,易升华。
2.化学性质:SO3表现出酸性氧化物的通性。
(1)与水反应: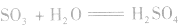 ,SO3遇水剧烈反应生成硫酸,同时放出大量的热,三氧化硫是硫酸的酸酐,又叫硫酐。
,SO3遇水剧烈反应生成硫酸,同时放出大量的热,三氧化硫是硫酸的酸酐,又叫硫酐。
(2)与碱反应:

(3)与碱性氧化物反应:
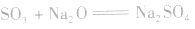
3.SO3的制法:
合金的概念:
由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
合金的特性:
合金与各成分金属相比,具有许多优良的物理、化学和机械性能。
(1)合金的硬度一般比它的成分金属的大。
(2)合金的熔点一般比它的成分金属的低。
钢:
(1)钢和生铁同属于铁的合金。将铁矿石冶炼成生铁,生铁进一步冶炼可成为钢。
(2)钢是用量最大、用途最广的合金,按其化学成分可分为两大类:碳素钢和合金钢。
(3)碳素钢俗称普通钢。根据含碳量的多少,碳素钢又可以分为三类,见下表:
| 合金名称 | 含碳 | 主要性质 |
| 低碳钢 | <0.3% | 韧性、焊接性好,但强度低 |
| 中碳钢 | 0.3%~0.6% | 强度高,韧性及加工性好 |
| 高碳钢 | >0.6% | 硬而脆,热处理后弹性好 |
| 名称 | 其他主要合金元素 | 主要特性 | 主要用途 |
| 锰钢 | 锰 | 韧性好,硬度大 | 钢轨、轴承、钢磨、挖掘机铲斗、坦克装甲 |
| 不锈钢 | 铬、镍 | 抗腐蚀性好 | 医疗器械、容器、炊具等 |
| 硅钢 | 硅 | 导磁性好 | 变压器、发电机和电动机的铁芯 |
| 钨钢 | 钨 | 耐高温,硬度大 | 刀具 |
其他几种常见合金的主要成分,性能和用途:
| 合金 | 主要成分 | 主要性能 | 主要用途 |
| 球墨铸铁 | 铁,碳,硅,锰 | 机械强度好 | 在某些场合可代替钢 |
| 黄铜 | 铜,锌 | 强度高、可塑性 好、易加工、耐腐蚀 |
机器零件、仪表、日用品 |
| 青铜 | 铜,锡 | 强度高、可塑性好、 耐磨、耐腐蚀 |
机器零件如轴承、齿轮等 |
| 白铜 | 镍,铜 | 光泽好、耐磨、 耐腐蚀、易加工 |
钱币、代替银做饰品 |
| 焊锡 | 锡,铅 | 熔点低 | 焊接金属 |
| 硬铝 | 铝,铜,锰,镁,硅 | 强度和硬度好 | 火箭、飞机、轮船等制造业 |
| 钛合金 | 钛,铝,钒 | 耐高温、耐腐蚀、高强度 | 用于宇航、飞机、造船,化学工业 |
| 金合金 | 金,银,铜,稀土元素 | 有光泽、易加工、耐磨、耐腐蚀、易导电 | 金饰品、电子元件、钱币、笔尖 |
| Ti-Fe合金 | Ti,Fe | 室温下吸收H2快,且吸收H2量大,稍稍加热放H2速率快 | 储氢合金 |
合金的分类:
(1)铝合金:常见的有镁铝合金、硬铝等。硬铝密度小,强度高,具有较强的抗腐蚀能力,是制造飞机和字宙飞船的理想材料。
(2)铜合金
(3)
(4)新型合金:钛合金、耐热合金和形状记忆合金等。
几种有色金属材料的比较及新型金属材料:
1.金,银,铜的重要物理性质,性能及应用比较
| 金 | 银 | 铜 | ||
| 物理性质 | 颜色 | 黄色 | 银白色 | 紫红色 |
| 硬度 | Au<Ag<Cu | |||
| 延展性 | Au>Ag>Cu | |||
| 导电性 | Ag>Cu>Au | |||
| 导热性 | Ag>Cu>Au | |||
| 性能 | 极高的抗腐蚀性 | 催化,抗腐蚀性 | 在潮湿空气中易锈蚀 | |
| 应用 | 电子工业,航空,航天工业 | 有机合成,能源开发,医用材料制造 | 电气和电子工业,建筑材料 | |
2.新型金属材料
(1)铀(U)用作核电站反应堆的核燃抖
(2)镅(Am)在烟雾探测器中用作烟雾监测材料
(3)钛(Ti)被誉为“21世纪的金属”,是一种“亲生物金属”
金属资源的合理开发和利用:
1.合理开采矿物地球上的金属矿产资源是有限的,而且是不可再生的。随着人类不断地开发利用,矿产资源日渐减少,节约并合理地开采矿产资源是合理利用金属资源最直接,最基本水的措施
2.防止金属腐蚀金属制品在使用过程中会因腐蚀而损坏,每年因腐蚀造成的钢铁资源损失占当年总产量的10%以上,因此防腐是避免金属资源损失、浪费的重要手段
3.回收和利用废旧金属回收的废旧金属制品,大部分可以重新制成金属或它们的化合物,再进行使用。例如废旧钢铁可以用于炼钢;废铁屑可用于制铁盐
4.寻找金属替代品随着金属资源的目益减少,利用可再生资源开发、研制出新型材料代替金属材料的应用,是当今社会的一项重要科研课题,例如已经研制出并已实际运用的高硬度、耐高温材料;新型的替代钢铁的无机非金属材料料;有机化工合成的各种强度的橡胶、塑料,复合材料等
与“下列说法正确的是( )A.凡pH<7的雨水就可看作“酸雨”B.燃...”考查相似的试题有:
- 现有下列物质:①NaCO3•10H2O晶体 ②铜 ③氯化氢 ④CO2⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(S...
- 某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到nmol F...
- 下列叙述正确的是( )A.阳离子只有氧化性,阴离子只有还原性B.含氧酸可作氧化剂而无氧酸不能C.在8NH3+3Cl2═N2+6NH4Cl反应...
- 下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )A.NO2、Na、Fe2+B.Cl2、Al、H2C.K+...
- 亚硝酸(HNO2)及其钠盐参加反应时既可作氧化剂又可作还原剂.当它们作还原剂时,生成的含氮产物可能是( )A.NOB.N2C.NO2...
- 在一定条件下KClO3与I2,按下列反应:2KClO3+I2=2KIO3+Cl2,则下列推断正确的是( )A.该反应的电子转移数目是10e-B.I2是氧...
- 日常生活中的许多现象都与化学反应有关,下列现象与氧化还原反应无关的是( )A.铁制菜刀生锈B.酸雨腐蚀大理石雕像C.铜制...
- (11分)某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验...
- (8分)过氧化氢(H2O2)是一种无色粘稠液体,其水溶液又俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。研究表明:H2O2具有立...
- 有关合金的叙述正确的是( )A.合金的密度比其各成分金属小B.合金的抗腐蚀性能都很好C.合金的导电性能比成分金属强D.多数...