本试题 “(1)写出4种有机物,它们完全燃烧产生的CO2和H2O(g)在同温同压下的体积比均为1:1,且能被新制的Cu(OH)2氧化的有机物的结构简式:A__________B__________C_____...” 主要考查您对羧酸的通性
有机物燃烧确定其组成
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 羧酸的通性
- 有机物燃烧确定其组成
羧酸:
1.概念:烃基跟羧基相连构成的有机化合物叫做羧酸。一元羧酸的通式为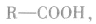 饱和一元羧酸的通式为
饱和一元羧酸的通式为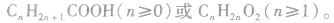
2.羧酸的分类:根据分子中烃基种类的不同,羧酸可分为脂肪酸和芳香酸等。分子中羧基与脂肪烃基相连的羧酸称为脂肪酸,如乙酸、硬脂酸;分子中羧基直接与苯环相连的羧酸称为芳香酸,如苯甲酸。
根据分子中羧基数目的不同,羧酸可分为一元羧酸、二元羧酸和多元羧酸等。分子中有一个羧基的羧酸称为一元羧酸,如乙酸;分子中有两个羧基的羧酸称为二元羧酸,如乙二酸(HOOC—COOH,俗称草酸)、对苯二甲酸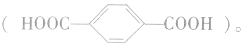
在一元羧酸里,酸分子的烃基含较多碳原子的称为高级脂肪酸,硬脂酸(C17H35COOH)、软脂酸(C15H31COOH)、油酸(C17H33COOH)都是常见的高级脂肪酸。
羟酸的性质:
1、羧酸的物理性质:
分子中碳原子数在4以下的羧酸能与水互溶。随着分子中碳链的增长,羧酸在水中的溶解度减小,直至与相对分子质量相近的烷烃溶解度相近。
羧酸分子间可以形成氢键。羧基中有两个氧原子,既可以像醇分子那样通过羟基氧和羟基氢形成氢键,也可以通过羰基氧和羟基氢形成氢键。由于羧酸分子形成氢键的机会比相对分子质量相近的醇多,所以羧酸的沸点比相应醇的沸点高。例如,乙酸和1一丙醇的相对分子质量都是60,但乙酸的沸点为117.9℃, 1一丙醇的沸点为97.2℃。
2、羧酸的化学性质
羧基由羰基和羟基组成,由于官能团之间的相互影响,使得羧酸的化学性质并不是羟基具有的化学性质和羰基具有的化学性质的简单加和。与醇羟基相比,羧基中羟基上的氢原子更易以离子形式电离出来,所以羧酸有酸性。与醛、酮的羰基相比,羧基中的羰基较难发生加成反应。羧酸很难通过催化加氢的方法被还原,用强还原剂如LiAlH4时才能将羧酸还原为相应的醇。
羧酸的主要化学性质如下:
(1)酸性
羧酸为弱电解质,羧酸、碳酸、苯酚的酸性由强到弱的顺序是: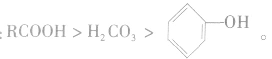 具有酸的通性。
具有酸的通性。 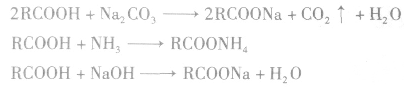
(2)酯化反应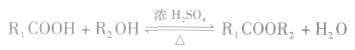
酯化反应也属于取代反应的范畴。酯化反应是制备酯的一种常用方法。
(3)形成酸酐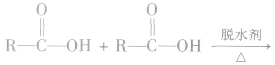
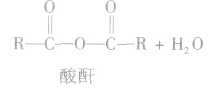
酸酐(羧酸分子间脱水的产物)可向有机化合物分 子提供酰基(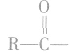 ),是良好的酰化试剂。
),是良好的酰化试剂。
5.重要的羧酸
(1)甲酸
甲酸的结构式为 ,分子中既有羧基又有醛基,所以甲酸既有羧酸的化学性质(如弱酸性、发生酯化反应),又有像醛一样的还原性(如被银氨溶液和新制氢氧化铜悬浊液氧化)。甲酸是组成最简单的羧酸,最早是从蚂蚁体内提取出来的,故又称蚁酸。甲酸是有刺激性气味的无色液体,有腐蚀性,能与水、乙醇、乙醚、甘油等互溶。甲酸在工业上可用作还原剂,在医疗上可用作消毒剂。
,分子中既有羧基又有醛基,所以甲酸既有羧酸的化学性质(如弱酸性、发生酯化反应),又有像醛一样的还原性(如被银氨溶液和新制氢氧化铜悬浊液氧化)。甲酸是组成最简单的羧酸,最早是从蚂蚁体内提取出来的,故又称蚁酸。甲酸是有刺激性气味的无色液体,有腐蚀性,能与水、乙醇、乙醚、甘油等互溶。甲酸在工业上可用作还原剂,在医疗上可用作消毒剂。
(2)乙酸
乙酸俗称醋酸,通常为无色液体,具有强烈的刺激性气味,沸点117.9℃,熔点16.60C。当温度低于 16.60c时,乙酸就凝结成像冰一样的晶体,所以纯净的乙酸又称冰醋酸。乙酸是一种重要的有机化工原料,用途极为广泛。乙酸可用于生产醋酸纤维、合成纤维(如维纶)、喷漆溶剂、香料、染料、医药以及农药等。乙酸还是人们生活中的调味剂,普通食醋中含3%~5%(质量分数)的乙酸。
目前工业上合成乙酸的主要方法是乙醛氧化法,即用醋酸锰为催化剂,用氧气或空气作氧化剂氧化乙醛生成乙酸。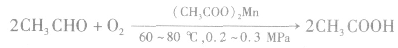
氢原子活性与物质的性质:
醇、酚、羧酸的结构中均有一OH,可分别称之为 “醇羟基”“酚羟基”和“羧羟基”。由于与这些一OH相连的基团不同,一OH受相连基团的影响就不同。故羟基上的氢原子活性也就不同,表现在性质上也相差较大,可比较如下: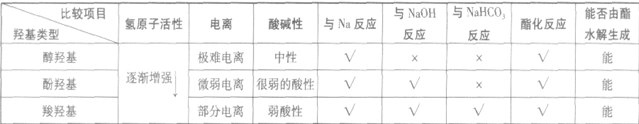
有机物燃烧确定其组成:
有机物完全燃烧后,各元素对应产物为:C→CO2,H→H2O,Cl→HCl。因此,我们可以根据有机物燃烧的产物分析判断该有机物的组成。
(1)某有机物完全燃烧后:若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。欲判定该有机物中是否含氧元素,首先求出CO2中碳元素的质量及H2O中氢元素的质量,然后将碳、氢元素的质量之和与原来有机物质量相比较,若两者相等,则原有机物的组成中不含氧,否则,原有机物的组成中含氧。生成的CO2和H2O的关系有:
①生成的CO2和H2O的体积比为1∶1的有:若为烃,则属于环烷烃或烯烃;若为烃的衍生物,则为醛、酮、羧酸、酯、葡萄糖、果糖等。
②生成的CO2和H2O的体积比为1∶2的有:甲烷、甲醇和尿素等含一个碳原子和四个氢原子的物质。
③生成的CO2和H2O的体积比为2∶1的有:分子中碳、氢原子数相同的物质,如:乙炔、苯、苯乙烯、苯酚等。
④当不同的有机物的物质的量相同时,此时有机物可写成:CxHy(H2O)n或CxOy(H2O)n的形式,耗氧只能由前一部分CxHy或CxOy完成,后面部分在燃烧过程中不耗氧。则组成为CxHy(H2O)n,每摩尔耗氧(x+y/4)mol;组成为CxOy(H2O)n的物质,每摩尔耗氧(x-y/2)mol;
特例:组成符合CxHy(H2O)n的物质中CH2O耗氧最少;组成符合CxOy(H2O)n的物质中,乙二醛耗氧最少。
(2)质量之和不变的两种有机物的燃烧规律:A、B两种有机物,不论以何种质量比进行混合,只要总质量保持一定,则完全燃烧时耗氧量与生成的CO2和H2O的量之间的关系说明:
①若生成的CO2量不变,则分二种情况:A、B的相对分子质量相同时,两者必为同分异构体;另一种情况是:A、B的相对分子质量不同时,则两者中的碳元素的质量分数必然相等,如:HCHO与CH3COOH;C16H34与C16H18O等
②若生成的H2O的量不变,也分二种情况:A、B的相对分子质量相同时,两者必为同分异构体;第二种情况是:A、B的相对分子质量不同时,则两者中的氢元素的质量分数必然相等,如:C2H2与C6H6、C8H8;C10H8与C6H8O3等
③若生成的CO2和H2O的量不变,也分二种情况:A、B的相对分子质量相同时,两者必为同分异构体;第二种情况是:A、B的相对分子质量不同时,则两者中的碳、氢元素的质量分数必然相等,即两者具有相同的最简式如:CH2O与C2H4O2、C3H6O3、C6H12O6等
(3)物质的量之和不变的两种有机物完全燃烧规律:A、B两种有机物,不论以何种比例进行混合,只要总物质的量保持一定,则完全燃烧时耗氧量与生成的CO2和H2O的量之间的关系说明:
①若A、B两者互为同分异构体时,相对分子质量相同,此时无论怎样混合,完全燃烧后消耗的氧气和生成的CO2和H2O的量都保持不变,这一点我们就不再考虑
②若生成的CO2的物质的量不变:A、B的相对分子质量不同时,则两者中的碳原子数必然相等,如:C2H4与C2H4O、C2H4O2等
③若生成的H2O的物质的量不变:A、B的相对分子质量不同时,则两者中的氢原子数必然相等,如:CH4、CH4O、C2H4O、C2H4O2等
④若生成的CO2和H2O的量不变:A、B的相对分子质量不同时,则两者中的碳、氢原子数都相等,如:CH4、CH4O;C2H4、C2H4O、C2H4O2等
⑤若消耗的氧气和生成的CO2的量保持不变:A、B的相对分子质量不同时,两者含碳原子数必相等,分子中必相差n个H2O,如:C2H4与C2H6O。
(6)若消耗的氧气和生成的H2O的量保持不变:A、B的相对分子质量不同时,则两者含氢原子数必相等,分子中必相差n个CO2,如:CH4与C2H4O2。
⑦若在反应过程中消耗氧的物质的量保持不变:A、B的相对分子质量不同时,若两者含碳原子数相等,则分子中必相差n个H2O,如:C2H4与C2H6O。而当两者的氢原子数相等时,则分子中必相差n个CO2,如:CH4与C2H4O2。
与“(1)写出4种有机物,它们完全燃烧产生的CO2和H2O(g)在同温同压...”考查相似的试题有:
- 某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为...
- 甲酸和乙醇发生酯化反应生成的酯的结构简式为( ) A.CH3COOCH3 B.HCOOCH3 C.HCOOCH2CH3 D.HCOOCH2CH2CH3
- 下列化合物中,既显酸性,又能发生加成反应、氧化反应、酯化反应和消去反应的是[ ]A.B.CH2(CHO)-CH2-CH(OH)-COOHC.CH3-CH=CH-...
- 使用有机材料制成的薄膜,给环境造成的“白色污染”后果十分严重。我国最近研制成功的一种可降解塑料结构如下该塑料有良好的生...
- 下列叙述中,正确的是[ ]①能发生酯化反应的酸一定是羧酸②油脂水解后得到的醇是丙三醇③天然蛋白质水解的最后产物是多种α-氨基...
- 下列物质中能发生加成、加聚和缩聚反应的有[ ]A.B.C. CH2=CH-COOHD.
- 在120℃ 时,下列物质与足量氧气混合,充分燃烧后恢复到原条件,反应前后气体体积不可能不发生变化的是[ ]A.甲烷.乙烯B.乙...
- 现有①甲烷、②乙烯、③苯、④乙酸、⑤葡萄糖5种有机物,请用序号或按题中要求作答:(1)分子中所有原子一定都共面的是__________...
- 在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是[ ]A.CH4和C2H4B.CH4和...
- 两种气态烷烃的混合物,在标准状况下其密度为1.16g·L-1,则关于此混合物组成的说法正确的是[ ]A.一定有甲烷B.一定有乙烷C....