本试题 “钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料生产...” 主要考查您对测定物质组成、成分含量
工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
金属、非金属的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
- 工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
- 金属、非金属的有关计算
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
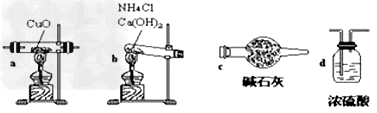
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
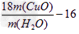
1.确定化工生产的最佳过程
确定化工生产反应原理与过程的一般方法:对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。
①分析产品的化学组成,据此确定生产产品的主要原料;
②分析产品与生产原料之间关键元素的性质,确定主要生产步骤;
③分析生产原料的性质.确定反应原理。
2.选择化工生产的最佳原料
选择原料首先要考虑化学反应原理,此外还要考虑厂址选择、原料供应、能源供应、工业用水供应、产品存储、产品运输、产品预处理成本、环境保护等。
3.控制最佳化学反应条件
控制反应条件是取得化工生产最佳综合效益的重要环节之一。控制反应条件要应用化学反应速率理论和化学平衡原理,结合具体化学反应的特点以及生产技术和设备条件、能源消耗等,控制最佳化学反应速率和反应物的平衡转化率。
4.科学治理工业“三废”
“三废”主要是指废气、废液和废渣。治理“三废” 首先要从设计生产工艺与选择原料做起,即从源头上解决问题;其次是把好排放关,对排出的“三废”的处理,要尽最大努力使其资源化,最低要求是无害化。
5.充分利用“废热”
通过热交换或其他方式利用化学反应所放出的热量。
硫代硫酸钠的工业制法:
(1)亚硫酸钠
将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得硫代硫酸钠。
Na2CO3+SO2==Na2SO3+CO2 Na2SO3+S+5H2O==Na2S2O3·5H2O
(2)硫化碱法
利用硫化碱蒸发残渣、硫化钡废水中的碳酸钠和硫化钠与硫磺废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2
(3)氧化、亚硫酸钠和重结晶法
由含硫化钠、亚硫酸钠和烧碱的液体经加硫、氧化;亚硫酸氢钠经加硫及粗制硫代硫酸钠重结晶三者所得硫代硫酸钠混合、浓缩、结晶,制得硫代硫酸钠。
2Na2S+2S+3O2==2Na2S2O3 Na2SO3+S==Na2S2O3
(4)重结晶法
将粗制硫代硫酸钠晶体溶解(或用粗制硫代硫酸钠溶液),经除杂,浓缩、结晶,制得硫代硫酸钠。
砷碱法净化气体副产 利用焦炉煤气砷碱法脱硫过程中的下脚(含Na2S2O3),经吸滤、浓缩、结晶后,制得硫代硫酸钠。
高锰酸钾的工业制法:
工业上利用二氧化锰制备高锰酸钾,其步骤是
(1)二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2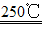 2K2MnO4+2H2O
2K2MnO4+2H2O
(2)电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH
2KMnO4+H2↑+2KOH
高锰酸钾常见的制备方法有以下两矿石中取得的二氧化锰和氢氧化钾在空气中或混合硝酸钾(提供氧气)加热,产生锰酸钾,再于碱性溶液中与氧化剂进行电解氧化得到高锰酸钾。 2MnO2+4KOH+O2→2K2MnO4+2H2O 2K2MnO4+Cl2→2KMnO4+2KCl
也可以用MnSO4在酸性环境中和二氧化铅(PbO2)或铋酸钠(NaBiO3)等强氧化剂反应产生。此反应也用于检验二价锰离子的存在,因为高锰酸钾的颜色明显种:
①法一:以MnO2(软锰矿)为原料制KMnO4
第一步:Mn(IV)→Mn(VI) 2MnO2+4KOH+O2====2K2MnO4+2H2O
第二步:CO2歧化K2MnO4 K2MnO4+2CO2====2KMnO4+MnO2+2K2CO3
这种制备方法的最高产率为66.7% 法
②电解法:阳极:2MnO42--2e-→2MnO4- 阴极:2H2O+2e-→H2↑+2OH- 总电解反应方程式为2K2MnO4+2H2O→2KMnO4+2KOH+H2↑
理论产率可达100%
纯硅的制取:
工业上在电炉内,用硅石和碳反应得粗硅和一氧化碳,然后用粗硅和氯气反应得四氯化硅,再用四氯化硅和氢气反应的纯硅和氯化氢,这样就完成硅的制造。(第一步完全相同,第二部有三种方法,工业上用的的是西门子的方法,其他两种不常见。)反应方程式
(1)石英制硅(冶金级),这一步是粗硅制取硅商业上是由高纯度的石英砂和木头,焦炭和煤使用碳棒电极在电弧炉中制得。在高于1900°C的温度下,依照下列方程式碳把石英砂还原成硅: SiO2+C→Si+CO2. SiO2+2C→Si+2CO. 这一过程所的硅称为冶金级硅。纯度为98%-99%。另外,硅制备办法还有熔盐电解法,即电解熔解的二氧化硅。
(2)高纯硅的制备在制备高纯硅之前,需要把粗硅转化成三氯化氢硅(300°C): Si+3HCl→HSiCl3+H2 接着,通过精馏使SiHCl3与其它氯化物分离,经过精馏的SiHCl3,其杂质水平可低于10-10%的电子级硅要求。然后,提纯后的SiHCl3通过CVD原理在1150°C下制备出多晶硅粉。2HSiCl3→Si+2HCl+SiCl4.
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: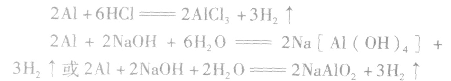
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为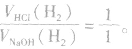
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为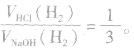
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为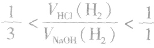 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: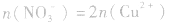
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
与“钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业...”考查相似的试题有:
- 向氢氧化钠浓溶液中加入氧化钙,加热制得的白色固体就是碱石灰,某实验小组为探究碱石灰的组成,设计了如下实验。取市售碱石...
- 化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均...
- 某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(1)补全上述①②③④各步反应的离子方...
- 某学习小组用下图装置测定铝美合金中铝的质量分数和铝的相对原子质量(1)A中试剂为__________(2)实验前,先将铝镁合金在稀...
- 北京市场销售的某种食用精制盐包装袋上有如下说明(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数...
- 将体积为VmL的试管充满NO 气体,按下图进行实验,当通入相同条件下O249 mL时,液面仍在原来位置,则试管体积V 为 [ ]A.49 mL...
- 在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2 mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液...
- 水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:(1)天然水中溶解的气...
- 由0.1 mol Al2O3和0.05 mol Na2O2固体组成的混合物,加入足量水中,然后再向其中加入1mol/L的盐酸,当溶液中的铝元素恰好变为...
- 某不纯铁片可能含有Mg、Al、Cu等金属杂质,取这种铁片5.6g与足量的稀盐酸反应,得到0.2g氢气,则该铁片中[ ]A.一定不含杂质B...