本试题 “将70克过氧化钠和氧化钠的混合物跟98克水充分反应后,收集到的气体体积在标准状况下为5.6L。(1)试分别写出过氧化钠和氧化钠跟水反应的化学方程式。 ① ② 。...” 主要考查您对氧化钠
过氧化钠
金属、非金属的有关计算
溶液质量分数的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化钠
- 过氧化钠
- 金属、非金属的有关计算
- 溶液质量分数的计算
氧化钠的基本性质:
白色固体,碱性氧化物,不稳定
(1)与水反应:Na2O+H2O==2NaOH
(2)与CO2反应:Na2O+CO2==Na2CO3
(3)与HCl反应:Na2O+2HCl==2NaCl+H2O
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 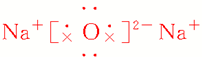 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
过氧化钠(Na2O2)的基本性质:
淡黄色固体,较稳定,可用作供氧剂、漂白剂
(1)与水反应:2Na2O2+2H2O==4NaOH+O2↑
(2)与CO2反应:2Na2O2+2CO2==2Na2CO3+ O2
(3)与HCl反应:2Na2O2+4HCl==4NaCl+2H2O+ O2↑
过氧化钠的特性及计算:
1.过氧化钠的强氧化性
2.Na2O2与CO2、H2O(g)反应的重要关系
(1)气体体积差的关系
2Na2O2+2CO2===2Na2CO3+O2 气体体积差 ①
2 1 ΔV=1
2Na2O2+2H2O(g)===4NaOH+O2 气体体积差 ②
2 1 ΔV=1
由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,即为生成氧气的量。
(2)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
(3)电子转移关系
当Na2O2与CO2或H2O反应时,每产生1molO2就转移2mol电子。
(4)固体质量变化关系
①足量过氧化钠与水、CO2反应的计算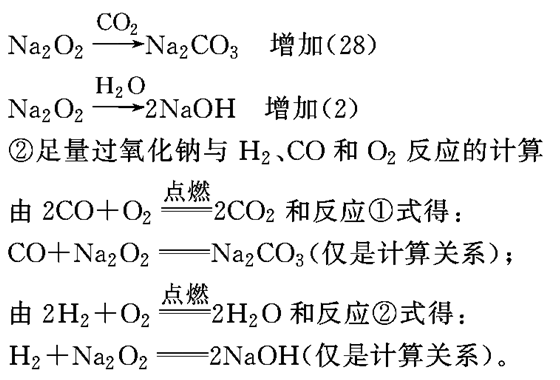
所以,有ag通式符合(CO)m(H2)n(m=0,1,2,3…,n=0,1,2,3…)的物质(包括纯净物和混合物)在氧气中燃烧,将其通过足量过氧化钠,反应完毕后,固体增重ag。
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 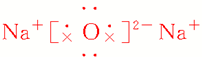 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
特别提醒:
(1)用脱脂棉包裹住过氧化钠,滴加少量水时脱脂棉可以燃烧,不仅可以说明Na2O2与H2O反应生成O2,还可以说明该反应放热。
(2)Na2O2与H2O反应时H2O既不是氧化剂也不是还原剂。
方法技巧:Na2O与Na2O2的结构与性质
(1)Na2O中只含离子键,Na2O2中既含离子键,又含非极性键。
(2)等物质的量的Na2O与Na2O2分别于等量且足量的H2O反应,所得溶液的成分浓度相同
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: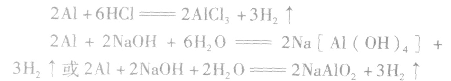
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为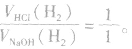
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为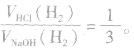
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为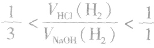 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: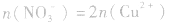
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
(1)溶质的质量分数=

(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:
①溶质的质量分数=
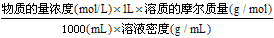
②物质的量浓度=

有关溶液密度的问题:
1.溶液质量分数与密度的关系
(1)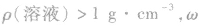 越大,则ρ(溶液)越大,常见溶液如NaCl溶液、硫酸溶液等。
越大,则ρ(溶液)越大,常见溶液如NaCl溶液、硫酸溶液等。
(2)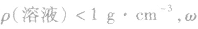 越大,则ρ(溶液)越小,常见溶液如氨水、酒精溶液等。
越大,则ρ(溶液)越小,常见溶液如氨水、酒精溶液等。
2.溶液混合后质量分数的变化规律
质量分数分别为 的两溶液(同种溶质)混合,混合后溶液的质量分数为ω。
的两溶液(同种溶质)混合,混合后溶液的质量分数为ω。
(1)等体积混合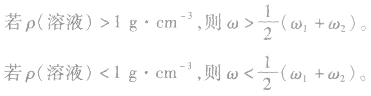
若是加等体积水稀释,可视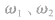 中其一为0 分析。
中其一为0 分析。
(2)等质量混合: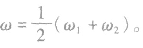
与“将70克过氧化钠和氧化钠的混合物跟98克水充分反应后,收集到...”考查相似的试题有:
- 向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是 ( )
- 相同质量的下列物质与足量盐酸反应,产生CO2气体最多的是A.Na2CO3B.NaHCO3C.K2CO3D.CaCO3
- 现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。(1)A装置的作用:_...
- 对于下列有关金属钠的叙述中,正确的是A.由于钠比较活泼,所以它能从溶液中置换出金属活动顺序表钠后面的金属B.1个钠原子能...
- A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去)。(1)若A是能使湿润红色石蕊试纸变蓝的气...
- 由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积...
- 将0.1mol的镁铝混合物溶于100mL 2mol·L-1的H2SO4中,然后再滴加1 mol·L-1的NaOH溶液。请回答:(1)若在滴加NaOH溶液的过程中...
- 有X、Y、Z三种常见元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色...
- 甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积...
- 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 mL 5 mol/L HCl溶液中,共收集到标准状况下...