本试题 “硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:(1)向大气中排放NOx可能导致的环境...” 主要考查您对二氧化硅
二氧化氮
新型材料(新型陶瓷、单晶硅等)
燃料和能源(氢能、风能、核能、太阳能等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硅
- 二氧化氮
- 新型材料(新型陶瓷、单晶硅等)
- 燃料和能源(氢能、风能、核能、太阳能等)
二氧化硅:
①化学式SiO2
②相对分子质量:60
③类别:酸性氧化物
④晶体类型:原子晶体
⑥晶体中粒子间的作用力:共价键
二氧化硅的物理性质和化学性质:
(1)物理性质:无色透明或白色粉末,原子晶体,熔沸点都很高,坚硬难熔,不溶于水,天然的二氧化硅俗称硅石,是构成岩石的成分之一。
(2)化学性质:不活泼
①不与水反应,不能跟酸(氢氟酸除外)发生反应。
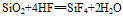 (氢氟酸不能盛放在玻璃容器中)。
(氢氟酸不能盛放在玻璃容器中)。②具有酸性氧化物的性质,能跟碱性氧化物或强碱反应。
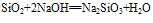 (实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
(实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
 (制玻璃)
(制玻璃)③具有弱氧化性


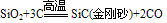
知识点拨:
二氧化硅晶体的结构若在硅晶体结构中的每个Si—Si键中“插入”一个氧原子,便可得到以硅氧四面体 (SiO4)为骨架的二氧化硅的结构,如图所示。在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,即每个硅原子与四个氧原子形成四个共价键,每个氧原子与两个硅原子形成共价键,因此,二氧化硅晶体中硅原子和氧原子的个数比为1:2,二氧化硅的化学式为SiO2.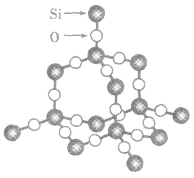
二氧化硅的用途:
①光导纤维的主要原料
②石英的主要成分是SiO2,纯净的石英可用来制造石英玻璃。石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。 水晶常用来制造电子工业中的重要部件、光学仪器,也用来制造高级工艺品和眼镜片。
③玛瑙石含有有色杂质的石英晶体,可用于制造精密仪器轴承,耐磨器皿和装饰品。
二氧化氮的物理性质和化学性质:
(1)物理性质:红棕色、有刺激性气味、有毒的气体,易溶于水、易液化,比空气重。
(2)化学性质:
与H2O反应: 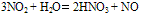
(工业制HNO3原理,在此反应中,NO2同时作氧化剂和还原剂)
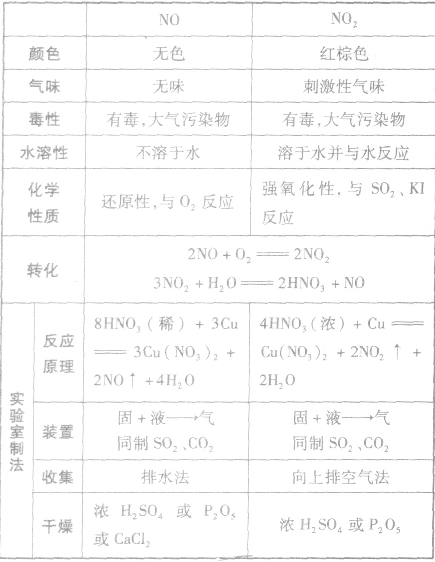
NO、NO2的性质、实验室制法的比较:
隐含反应: 的应用:
的应用:
通常“纯净”的NO2或N2O4并不纯,因为在常温、常压下能发生反应 ,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
1.收集到的1mo1NO2在标准状况下的体积应小于22.4L
2.标准状况下22.4LNO2的质量大于46g。
3.NO与O2混合后,所得物质的相对分子质量应大于按体积比求得的数值。
4.温度影响“ ”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
5.恒容时,在“ ”平衡体系中增加 N01,相当于增大压强。
”平衡体系中增加 N01,相当于增大压强。
有关混合气体NO、NO2、O2溶于水的计算:
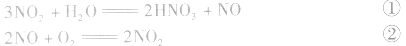
①×2+②得NO2、O2与水反应生成HN3,的化学方程式为: 
①×2+②×3得NO、O2与水反应生成HNO3的化学方程式为: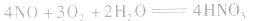
一般NO、NO2、O2与水反应,可归纳成四种情况:
1.NO和NO2混合 剩余气体为NO
剩余气体为NO
2.NO2和O2混合
3.NO和O2混合 
4.NO2、NO、O2的混合
当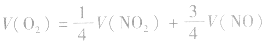 时,反应后无气体剩余
时,反应后无气体剩余
特例:当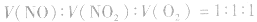 时,无气体剩余。
时,无气体剩余。
新型无机非金属材料的特性:
①能承受高温、强度高②具有光学特性③具有电学特性④具有生物功能
新型陶瓷:
①碳化硅陶瓷:将二氧化硅与碳在电炉中加热至1900℃以上可制得碳化硅:
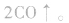 碳化硅陶瓷具有像金刚石一样的内部结构,晶体属于原子晶体。碳化硅陶瓷硬度高,可耐2000℃的高温,有较高的高温强度,化学性质稳定,耐腐蚀性强。
碳化硅陶瓷具有像金刚石一样的内部结构,晶体属于原子晶体。碳化硅陶瓷硬度高,可耐2000℃的高温,有较高的高温强度,化学性质稳定,耐腐蚀性强。
碳化硅陶瓷可用于制造高温耐蚀部件、研磨盘、密封环、防弹板,用作研磨介质、航天器的涂层材料等。
②氮化硅陶瓷:将高纯硅与纯氮气加热至1300℃ 可制得氮化硅:
氮化硅陶瓷是一种超硬物质,本身具有润滑性,并且耐磨损:除氢氟酸外,不与其他无机酸反应,抗腐蚀能力强,高温时也能抗氧化。而且它还能抵抗冷热冲击,在空气中加热到1000℃以上,急剧冷却再急剧加热,也不会碎裂。
氮化硅陶瓷可用于制造轴承、汽轮机叶片、机械密封环、永久性模具等机械构件以及发动机受热面等。
③氧化铝陶瓷:氧化铝陶瓷(人造刚玉)是一种极有前途的高温结构材料。它的熔点很高,可用作高级耐火材料,如坩埚、高温炉管等。利用氧化铝陶瓷硬度高的优点,可以制造在实验室中使用的刚玉球磨机,用来研磨比它硬度小的材料。用高纯度的原料,使用先进工艺,还可使氧化铝陶瓷变得透明,可制作高压钠灯的灯管。
现代信息基础材料——单晶硅:
硅是目前半导体工业最重要的基础材料,其导电特性对杂质等十分敏感,因此必须首先制备高纯度的硅,然后精确控制掺杂元素的量和种类,并使它们均匀分布于材料之中。
粗硅制取: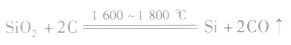
高纯硅制取:
新型无机非金属材料的品种:
(1)氧化铝陶瓷(人造刚玉)
特性:①高熔点 ②高硬度 ③可制成透明陶瓷
用途:高级耐火材料,刚玉球磨机,高压钠灯的灯管等
(2)氮化硅陶瓷
特性:①高硬度,耐磨损 ②抗腐蚀。高温时抗氧化 ③抗冷热冲击 ④耐高温且不易传热 ⑤本身具有润滑性
用途:制造轴承、汽轮机叶片、机械密封环、永久性模具等机械构件,用于制造发动机部件的受热面等
1.能源的分类:

2.各种能源的特点:
(1)传统燃料。柴草是农村使用的重要能源,但它的利用率低,且污染严重。
(2)化石燃料。这是人们目前使用的主要能源,它们的蕴藏量有限,而且不能再生,最终会枯竭,属于不可再生能源。
(3)新能源。新能源来源丰富,多数可以再生,没有污染或污染很小,所以可能成为未来的主要能源,但它们也有自己的缺点,如太阳能的能量密度低,使用成本高;氢能储仔、运输困难;风能不稳定,受地区、季节、气候的影响大。
3.我国的能源状况
(1)能源种类。我国的能源种装有化石燃料、水能和核能,其中化石燃料和水能的人均值太低,核能—一铀已探日月的储量很低,仅够4000万干瓦核电站运行 30年。
(2)我国能源的总消费量和人均消费量从改革开放以来~直到1995年逐年增加,从1995年开始有减少的趋势。
(3)我国能源利用率低,只有9%,能源节约的空间很大。
4.使用化石燃料的利弊及新能源的开发
(1)燃料充分燃烧的两个条件:
①要有足够的空气;
②燃料与空气要有足够大的接触面积。
(2)重要的化石燃料:煤、石油、天然气
(3)煤作燃料的利弊问题:
①煤是重要的化工原料;
②煤直接燃烧时产生SO2等有毒气体和烟尘,对环境造成严重污染;
③煤作为固体燃料,燃烧反应速率小,热利用率低,且运输不方便;
④可以通过清洁煤技术,如煤的液化和气化以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(4)新能源的开发:
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发新能源等;
②现在正在探索的新能源有太阳能、地热能、海洋能、生物质能、风能和氢能等。
与“硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、...”考查相似的试题有:
- 下列有关物质性质的运用错误的是①Na2O2与CO2反应放出氧气:矿山、坑道等供呼吸之用 ②各种金属单质特殊的焰色:节日焰火 ③三聚...
- 某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠.设计装置如下:(忽略装置中空气的影响...
- 用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列...
- (7分)已知3Cu+8HNO3==3Cu(NO3)2+2NO+4H2O(1)该反应的还原产物是 。(2)将化学方程式改写成离子方程式。 若有6mole-发生...
- 钠玻璃中Na2O、CaO、SiO2三者的物质的量之比为1∶1∶6,则钠玻璃中Na2SiO3、CaSiO3、SiO2的物质的量之比为( )A.1∶1∶6B.2∶1∶...
- 根据下列物质的化学性质,判断其应用错误的是( )A.高纯度的硅单质广泛用于制作光导纤维B.CaO能与SO2反应,可作工业废气的...
- (12分)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。试回答下列问题:(1)写出用海滩上的贝克...
- (12分)(1)用于金属焊接的某种焊条,其药皮由大理石(CaCO3)、水泥、硅、铁等配制而成。①Al的原子结构示意图为__________...
- 2010年上海世博会的主题是“城市,让生活更美好”。大会提倡低碳、节能、环保,下列措施中不符合该主题的是[ ]A.世博园区公共...
- 化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.下列做法与此理念相违背的是( )A.在食品中大...