本试题 “1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2. 18 g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中...” 主要考查您对乙醇
其他物质的制备(硫酸铜晶体、铁红等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙醇
- 其他物质的制备(硫酸铜晶体、铁红等)
乙醇分子的组成与结构:
乙醇分子可以看成是乙烷分子中的一个氢原子被羟基(一OH)取代而形成的。乙醇分子的组成与结构见下表: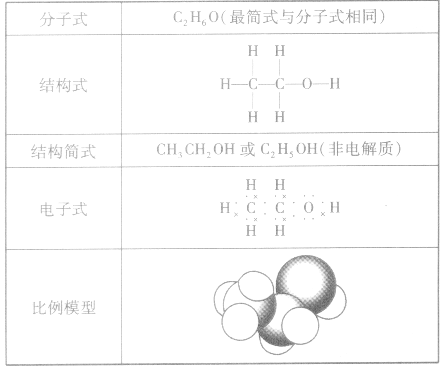
乙醇的性质:
(1)物理性质:俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。
(2)乙醇的化学性质:
①乙醇可以与金属钠反应,产生氢气,但不如水与金属钠反应剧烈。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
活泼金属(钾、钙、钠、镁、铝)可以将乙醇羟基里的氢取代出来。
②乙醇的氧化反应:
2CH3CH2OH+O2→2CH3CHO+2H2O(条件是在催化剂Cu或Ag的作用下加热)
③乙醇燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2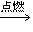 2CO2+3H2O
2CO2+3H2O
④乙醇可以和卤化氢发生取代反应,生成卤代烃和水。
C2H5OH+HBr→C2H5Br+H2O
注意:通常用溴化钠和硫酸的混合物与乙醇加热进行该反应。故常有红棕色气体产生。
⑤乙醇可以在浓硫酸和高温的催化发生脱水反应,随着温度的不同生成物也不同。
A. 消去(分子内脱水)制乙烯(170℃浓硫酸) C2H5OH→CH2=CH2↑+H2O (消去反应)
B. 缩合(分子间脱水)制乙醚(140℃ 浓硫酸) 2C2H5OH→C2H5OC2H5+H2O(取代反应)
有关醇类的反应规律:
1.消去反应的规律
总是消去和羟基所在碳原子相邻的碳原子上的氢原子,没有相邻的碳原子(如CH3OH)或相邻的碳原子上没有氢原子(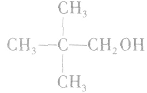 )就不能发生消去反应。能发生消去反应的醇的结构特点为:
)就不能发生消去反应。能发生消去反应的醇的结构特点为: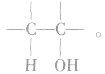
2.催化氧化反应的规律:
与羟基相连的碳原子上若有2个或3个氢原子,羟基则易被氧化为醛;若有1个氢原子,羟基则易被氧化为酮;若没有氢原子,则羟基一般不能被氧化。即
3.酯化反应的规律
醇与羧酸或无机含氧酸发生酯化反应,一般规律是“酸去羟基醇去氢”即酸脱去一OH,醇脱去一H。
例如: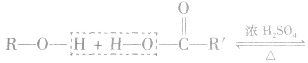

可用氧的同位素: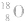 作为示踪原子来确定反应机理。如:
作为示踪原子来确定反应机理。如: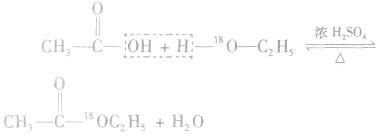
乙醇的工业制法:
(1)乙烯水化法:
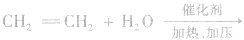
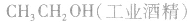
(2)发酵法:

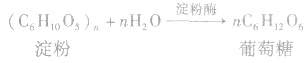
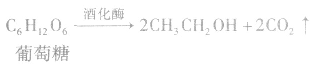
(1)反应原理:CH3COONa+NaOH
 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
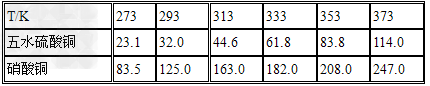
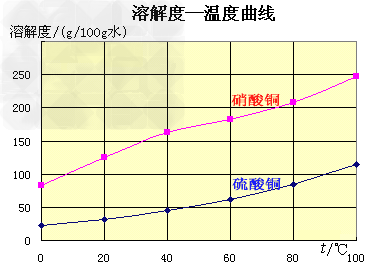
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
与“1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,...”考查相似的试题有:
- 以下实验能获得成功的是( )A.用含结晶水的醋酸钠和碱石灰共热制甲烷气体B.将铁屑、溴水、苯混合制溴苯C.在苯酚溶液中滴...
- 质量为a g的铜丝,在空气中灼热变黑,趁热放入下列物质中,铜丝变红,质量仍为a g的是( )A.盐酸B.CH3COOHC.C2H5OHD.HNO3
- 下列说法正确的是[ ]A.石油化工水平的标志是乙烯产量B.天然气的主要成分是丙烷C.糖尿病患者不可以用新制备的氢氧化铜检验D...
- (4分)实验室用乙醇和浓H2SO4反应制取乙烯时,常发现反应混合液变黑,同时制得的乙醇具有刺激性气味,它是浓H2SO4氧化了乙醇...
- (12分)四氧化三铁纳米微粒可用于涂料、油墨、隐身材料、磁记录、电极材料、催化剂等多领域,实验室可用如下的方法来制备这...
- Ⅰ、下列实验操作不正确的是 ;①用分液漏斗分离环己烷和苯的混合液体②将10滴溴乙烷加入到1 mL 10%的烧碱溶液中,加热片刻后,...
- (14分)硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫...
- 某课外实验小组设计的下列实验不合理的是( )A.制备并观察氢氧化亚铁B.证明过氧化钠与水反应放热C.制备并收集少量NO2气体...
- (19分)二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下...
- 是一种重要的化工原料。某研究性学习小组设计了利用菱镁矿石(主耍成分是,并含有杂质)制取的实验,流程如下(1) 第①步研磨的...