本试题 “下列叙述正确的是[ ]A.不同元素的根本区别在于其相对原子质量的不同B.元素化学性质与其原子的最外层电子数目关系非常密切C.不同元素组成的物质是混合物D....” 主要考查您对纯净物和混合物
氧化物
元素的定义
决定元素的化学性质的因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 纯净物和混合物
- 氧化物
- 元素的定义
- 决定元素的化学性质的因素
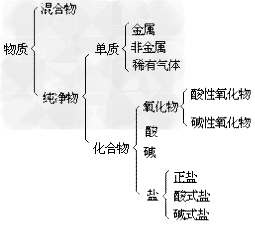
混合物:
(1)概念:由两种或多种物质混合而成的物质,没有有固定的组成,各成分保持自己原有的化学性质。
(3)常见的混合物:空气、合金、矿石、溶液等。
(4)混合物的提纯:混合物经过物理或化学的方法可以提纯。
纯净物:
(1)概念:只由一种物质组成的物质。
(3)纯净物的分类:纯净物根据物质组成的元素种类,分为两大类:单质和化合物。
纯净物和氧化物的区别:
| 纯净物 | 混合物 | |
| 概念 | 宏观:由一种物质组成的物质 微观:由同种分子构成(对于由分子构成的物质而言) |
宏观:由两种或多种物质组成的物质 微观:由不同种分子构成(对于由分子构成的物质而言) |
| 区别 | 由同种物质组成(对于由分子构成的物质,是由同种分子构成的),组成是固定的 | 由不同种物质组成(对于由分子构成的物质. 是由不同种分子构成的),组成是不固定的 |
| 特点 | ①具有固定的组成 ②具有一定的性质 ③有专门的化学符号 |
①没有固定的组成和性质 ②各成分保持各自的性质 ③没有专门的化学符号 |
| 分离方法 | 组成固定,不需分离;若需将化合物分成几种单质,则必须通过化学方法才能实现 | 物理方法: 筛选 过滤 蒸馏 |
| 实例 | 氧气,二氧化碳,高锰酸钾 | 空气,粗盐,蔗糖水 |
| 联系 | 纯净物是相对而言的,自然界中绝对纯净的物质是不存在的,通常的纯净物是指含杂质很少的具有高纯度的物质。两者间的关系为 | |
对纯净物和混合物概念的理解:
(1)混合物概念:混合物可以看作是由几种纯净物混合而成的,混合物的形成过程中发生的是物理变化。由于混合物的组成一般不固定,所以往往不能用化学式表示。
(2)纯净物概念:纯净物只由一种物质组成,有固定的组成.可以用化学式表示。
常考的纯净物与混合物:
(1)混合物:石油、煤、天然气、洁净的空气、生理盐水、矿泉水、汽水、碘酒、白酒、双氧水、盐酸、合金等都是混合物。
(2)纯净物:水银、烧碱、纯碱、胆矾、液态氧、液态氮、蒸馏水(纯水)、干冰、冰水共存物、金刚石、石墨、生石灰、熟石灰、氯化钠、氧化铁等都是纯净物:
物质的分类示意图:
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
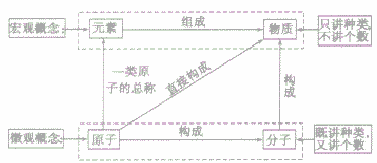
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
原子最外层电子数决定了元素的化学性质。
1—20号元素的性质:
1. 氢
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。1787年法国化学家拉瓦锡证明氢是一种单质并命名。氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。在宇宙中,氢是最丰富的元素。在地球上氢主要以化和态存在于水和有机物中。有三种同位素:氕、氘、氚。氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米3/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。在高温下,氢是高度活泼的。除稀有气体元素外,几乎所有的元素都能与氢生成化合物。非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
2. 氦
元素符号He,原子序数2,原子量4.002602,为稀有气体的一种。元素名来源于希腊文,原意是“太阳”。1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。后有人用无机酸处理沥青铀矿时得到一种不活泼气体,1895年英国科学家拉姆赛用光谱证明就是氦。以后又陆续从其他矿石、空气和天然气中发现了氦。氦在地壳中的含量极少,在整个宇宙中按质量计占23%,仅次于氢。氦在空气中的含量为0.0005%。氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上是氦4。氦在通常情况下为无色、无味的气体;熔点-272.2°C(25个大气压),沸点-268.9°C;密度0.1785克/升,临界温度-267.8°C,临界压力2.26大气压;水中溶解度8.61厘米3/千克水。氦是唯一不能在标准大气压下固化的物质。液态氦在温度下降至2.18K时,性质发生突变,成为一种超流体,能沿容器壁向上流动,热传导性为铜的800倍,并变成超导体;其比热容、表面张力、压缩性都是反常的。
氦是最不活泼的元素,基本上不形成什么化合物。氦的应用主要是作为保护气体、气冷式核反应堆的工作流体和超低温冷冻剂。
3. 锂
原子序数3,原子量6.941,是最轻的碱金属元素。元素名来源于希腊文,原意是“石头”。1817年由瑞典科学家阿弗韦聪在分析透锂长石矿时发现。自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷铝石等。在人和动物机体、土壤和矿泉水、可可粉、烟叶、海藻中都能找到锂。天然锂有两种同位素:锂6和锂7。金属锂为一种银白色的轻金属;熔点为180.54°C,沸点1342°C,密度0.534克/厘米3,硬度0.6。金属锂可溶于液氨。
锂与其它碱金属不同,在室温下与水反应比较慢,但能与氮气反应生成黑色的一氮化三锂晶体。锂的弱酸盐都难溶于水。在碱金属氯化物中,只有氯化锂易溶于有机溶剂。锂的挥发性盐的火焰呈深红色,可用此来鉴定锂。 锂很容易与氧、氮、硫等化合,在冶金工业中可用做脱氧剂。锂也可以做铅基合金和铍、镁、铝等轻质合金的成分。锂在原子能工业中有重要用途。
4. 铍
原子序数4,原子量9.012182,是最轻的碱土金属元素。1798年由法国化学家沃克兰对绿柱石和祖母绿进行化学分析时发现。1828年德国化学家维勒和法国化学家比西分别用金属钾还原熔融的氯化铍得到纯铍。其英文名是维勒命名的。铍在地壳中含量为0.001%,主要矿物有绿柱石、硅铍石和金绿宝石。天然铍有三种同位素:铍7、铍8、铍10。铍是钢灰色金属;熔点1283°C,沸点2970°C,密度1.85克/厘米3,铍离子半径0.31埃,比其他金属小得多。
铍的化学性质活泼,能形成致密的表面氧化保护层,即使在红热时,铍在空气中也很稳定。铍即能和稀酸反应,也能溶于强碱,表现出两性。铍的氧化物、卤化物都具有明显的共价性,铍的化合物在水中易分解,铍还能形成聚合物以及具有明显热稳定性的共价化合物。 金属铍主要用作核反应堆的中子减速剂。铍铜合金被用于制造不发生火花的工具,如航空发动机的关键运动部件、精密仪器等。铍由于重量轻、弹性模数高和热稳定性好,已成为引人注目的飞机和导弹结构材料。
铍化合物对人体有毒性,是严重的工业公害之一。
5. 硼
原子序数5,原子量10.811。约公元前200年,古埃及、罗马、巴比伦曾用硼沙制造玻璃和焊接黄金。1808年法国化学家盖·吕萨克和泰纳尔分别用金属钾还原硼酸制得单质硼。硼在地壳中的含量为0.001%。天然硼有2种同位素:硼10和硼11,其中硼10最重要。硼为黑色或银灰色固体。晶体硼为黑色,熔点约2300°C,沸点3658°C,密度2.34克/厘米3,硬度仅次于金刚石,较脆。属于非金属元素,符号B
6. 碳
是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。
碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。碳化合物一般从化石燃料中获得,然后再分离并进一步合成出各种生产生活所需的产品,如乙烯、塑料等。碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。常温下单质碳的化学性质比较稳定,不溶于水、稀酸、稀碱和有机溶剂;不同高温下与氧反应,生成二氧化碳或一氧化碳;在卤素中只有氟能与单质碳直接反应;在加热下,单质碳较易被酸氧化;在高温下,碳还能与许多金属反应,生成金属碳化物。
7. 氮
原子序数7,原子量为14.006747。元素名来源于希腊文,原意是“硝石”。1772年由瑞典药剂师舍勒和英国化学家卢瑟福同时发现,后由法国科学家拉瓦锡确定是一种元素。氮在地壳中的含量为0.0046%,自然界绝大部分的氮是以单质分子氮气的形式存在于大气中,氮气占空气体积的78%。氮的最重要的矿物是硝酸盐。氮有两种天然同位素:氮14和氮15,其中氮14的丰度为99.625%。
8. 氧
通常条件下呈无色、无臭和无味的气体。密度1.429克/升,1.419克/厘米3(液),1.426克/厘米3(固)。熔点-218.4℃,沸点-182.962℃,化合价一般为0和-2。电离能为13.618电子伏特。除惰性气体外的所有化学元素都能同氧形成化合物。大多数元素在含氧的气氛中加热时可生成氧化物。有许多元素可形成一种以上的氧化物。氧分子在低温下可形成水合晶体O2﹒H2O和O2﹒2H2O,后者较不稳定。氧气在空气中的溶解度是:4.89毫升/100毫升水(0℃),是水中生命体的基础。氧在地壳中丰度占第一位。干燥空气中含有20.946%体积的氧;水有88.81%重量的氧组成。除了O16外,还有O17和O18同位素。
9. 氟
原子序数9,原子量18.9984032,元素名来源于其主要矿物萤石的英文名。1812年法国科学家安培指出氢氟酸中含有一种新元素,但自由状态的氟一直没有制得。直到1886年,法国化学家穆瓦桑将氟化钾溶解在无水氢氟酸中进行电解,才制得单质氟。由于氟非常活泼,所以自然界中不存在游离状态的氟。氟在地壳中的含量为0.072%,重要的矿物有萤石、氟磷酸钙等。氟的天然同位素只有氟19。
氟是化学性质最活泼、氧化性最强的物质,氟能同所有其他元素化合;氟与溴、碘、硫、磷、碳、硅等物质在低温下就能猛烈化合;氟离子体积小,容易与许多正离子形成稳定的配位化合物;氟与烃类会发生难以控制的快速反应,氟与NaOH反应:2NaOH+2F2=2NaF+H2O+OF2,氟与水反应:2H2O+2F2 =4HF+O2。
10. 氖(neon)
一种化学元素。化学符号Ne,原子序数10,原子量20.1797,属周期系零族,为稀有气体的成员之一。1898年英国W.拉姆齐和M.W.特拉弗斯在液态空气中发现一种新的稀有气体,取名neon,含义是新奇。氖在地球大气中的含量为18.18×10-4%(体积百分),有3种同位素:氖20、氖21和氖22。氖是无色、无臭、无味的气体,熔点-248.67℃,沸点-245.9℃,气体密度0.9002克/升(0℃,1×105帕),在水中的溶解度10.5微升/千克水。在一般情况下,氖不生成化合物。氖可由液态空气分馏产物经低温选择吸附法制取。氖在放电时发出橘红色辉光,用于制造霓虹灯,还大量用于高能物理研究。
11. 钠
原子序数11,原子量22.989768,是最常见的碱金属元素。元素名来源拉丁文,原意是“天然碱”。1807年英国化学家戴维首先用电解熔融的氢氧化钠的方法制得钠,并命名。在地壳中钠的含量为2.83%,居第六位,主要以钠盐的形式存在。钠是有银白色光泽的软金属,用小刀就能很容易的切割。熔点97.81°C,沸点882.9°C,密度0.97克/厘米3。通常保存在煤油中。
钠是一种活泼的金属。钠与水会产生激烈的反应,生成氢氧化钠和氢;钠还能与钾、锡、锑等金属生成和金;金属钠与汞反应生成汞齐,这种合金是一种活泼的还原剂,在许多时候比纯钠更适用。钠离子能使火焰呈黄色,可用来灵敏地检测钠的存在。 以往金属钠主要用于制造车用汽油的抗暴剂,但由于会污染环境,已经日趋减少。金属钠还用来制取钛,及生产氢氧化钠、氨基钠、氰化钠等。熔融的金属钠在增值反应堆中可做热交换剂。
12. 镁
原子序数12,原子量24.305,为碱土金属中最轻的结构金属。1808年英国化学家戴维通过电解氧华镁和氧化汞的混合物,制得镁汞齐,蒸出其中的汞后,析出金属镁。1828年法国科学家比西用金属钾还原熔融的无水氯化镁得到纯镁。镁在地壳中的含量约2.5%,是第8个最丰富的元素。镁的矿物主要有菱镁矿、橄榄石等。海水中也含有大量的镁。镁也存在于人体和植物中,它是叶绿素的主要组分。 镁为银白色金属;熔点648.8°C,沸点1107°C,密度1.74克/厘米3。镁具有优良的切削加工性能。
金属镁能与大多数非金属和酸反应;在高压下能与氢直接合成氢化镁;镁能与卤化烃或卤化芳烃作用合成格利雅试剂,广泛应用于有机合成。镁具有生成配位化合物的明显倾向。 镁是航空工业的重要材料,镁合金用于制造飞机及森、发动机零件等;镁还用来制造照相和光学仪器等;镁及其合金的非结构应用也很广;镁作为一种强还原剂,还用于钛、锆、铍、铀和铪的生产中。
13. 铝
银白色有光泽金属,密度2.702克/厘米3,熔点660.37℃,沸点2467℃。化合价+3。具有良好的导热性、导电性,和延展性,电离能5.986电子伏特。
虽是叫活泼的金属,但在空气中其表面会形成一层致密的氧化膜,使之不能与氧、水继续作用。在高温下能与氧反应,放出大量热,用此种高反应热,铝可以从其它氧化物中置换金属(铝热法)。例如:8Al+3Fe3O4=4Al2O3+9Fe+795千卡,在高温下铝也同非金属发生反应,亦可溶于酸或碱放出氢气。对水、硫化物,浓硫酸、任何浓度的醋酸,以及一切有机酸类均无作用。
14. 硅
密度:2.33 熔点:1410℃ 沸点:2355℃ 性状:有无定形和晶体两种同素异形体,灰色或黑色。溶解情况:不溶于水、硝酸和盐酸,溶于氢氟酸和碱液。晶型硅单质具有和金刚石类似的空间立体网状结构。所以表现出硬度大,熔点高,质地脆的物理性质,另外硅元素为有周期表的梯形线上,性质介于金属和非金属之间,是灰黑色有金属光泽的半导体。
常温下不活泼,但能与HF反应生成SiF4和H2;能与氢氧化钠溶液反应生成Na3SiO3和H2。加热时与氧反应生成二氧化硅;与氯气反应生成SiCl4;与碳反应生成SiC 。
主要用途:半导体材料,如计算机芯片,新型能源如太阳能电池的硅晶板
15. 磷
单质磷有几种同素异形体。其中,白磷或黄磷是无色或淡黄色的透明结晶固体。密度1.82克/厘米3。熔点44.1℃,沸点280℃,着火点是40℃。放于暗处有磷光发出。有恶臭。剧毒。白磷几乎不溶于水,易溶解与二硫化碳溶剂中.在高压下加热会变为黑磷,其密度2.70克/厘米3,略显金属性。电离能为10.486电子伏特。不溶于普通溶剂中。白磷经放置或在400℃密闭加热数小时可转化为红磷。红磷是红棕色粉末,无毒,密度2.34克/厘米3,熔点59℃,沸点200℃,着火点240℃。不溶于水。在自然界中,磷以磷酸盐的形式存在,是生命体的重要元素。存在于细胞、蛋白质、骨骼和牙齿中。在含磷化合物中,磷原子通过氧原子而和别的原子或基团相联结
16.硫
通常为淡黄色晶体,它的元素名来源于拉丁文,原意是鲜黄色。单质硫有几种同素异形体,菱形硫(斜方硫)和单斜硫是现在已知最重要的晶状硫。它们都是由S8环状分子组成。
密度 熔点 沸点 存在条件
菱形硫(S8)2.07克/厘米3 112.8℃ 444.674℃ 200℃以下
单斜硫(S8)1.96克/厘米3 119.0℃ 444.6℃ 200℃
以上硫单质导热性和导电性都差。性松脆,不溶于水,易溶于二硫化碳(弹性硫只能部分溶解)。无定形硫主要有弹性硫,是由熔态硫迅速倾倒在冰水中所得。不稳定,可转变为晶状硫(正交硫),正交硫是室温下唯一稳定的硫的存在形式。
17.氯
常温常压下为黄绿色气体。密度3.214克/升。熔点-100.98℃,沸点-34.6℃。化合价-1、+1、+3、+5和+7。有毒,剧烈窒息性臭味。电离能12.967电子伏特,具有强的氧化能力,能与有机物和无机物进行取代和加成反应;同许多金属和非金属能直接起反应。
18. 氩
其是单原子分子,单质为无色、无臭和无味的气体。是稀有气体中在空气中含量最多的一个,100升空气中约含有934毫升。密度1.784克/升。熔点-189.2℃。沸点-185.7度。电离能为15.759电子伏特。化学性极不活泼,按化合物这个词的一般意义来说,它是不会形成任何化合物的。氩不能燃烧,也不能助燃。
19. 钾
原子序数19,原子量39.0983。元素名来源于拉丁文,原意是“碱”。1807年由英国化学家戴维首次用电解法从氢氧化钾熔体中制得金属钾,并定名。钾在地壳中的含量是2.59%,居第七位。重要的价矿物有钾石盐、钾硝石等;海水中含有氯化钾,其含量为氯化钠的1/40;土壤中的钾很容易进入植物组织,所以植物灰中都含有碳酸钾。钾有三种天然同位素:钾39、钾40和钾41。钾是一种轻而软的低熔点金属;熔点为63.25°C,沸点760°C,密度0.86可/厘米3。
钾比钠活泼,金属钾与水或冰的反应,即使温度低到-100°C,也非常剧烈;与酸的水溶液反应更为剧烈。金属钾在空气中燃烧,易生成橘红色的超氧化钾。金属钾与氢气反应很慢,但在400°C时反应很快。金属钾与一氧化碳反应能生成一种爆炸性的羰基化合物。含钾的化合物能使火焰呈现紫色。 钾盐是重要的肥料,是植物生长的三大营养元素之一。
20. 钙
原子序数20,原子量40.078,是碱土金属中最活泼的元素。元素名来源于拉丁文,愿意为“石灰”。1808年英国化学家戴维在电解石灰和氧化汞的混合物时得到钙汞齐,然后蒸掉汞制得纯的金属钙。钙在地壳中的含量为3.64%,排第5位。钙以化合物的形式广泛存在于自然界中,钙的主要矿物有石灰石、方解石、大理石等。 钙呈银白色;熔点839°C,沸点1484°C,密度1.54克/厘米3。
钙的氧化态为+2,它能同空气中的氧和氮缓慢作用生成一层氧化物和氮化物保护膜;钙与冷水作用缓慢,在热水中发生剧烈反应放出氢;钙可与卤族元素直接反应,在加热下与硫、碳反应;钙与浓氨水形成六氨合钙,这是一种有金属光泽的高导电性固体。
钙在生物体中是一种重要的元素。动物体内的钙不仅参加骨骼和牙齿的组成,而且参与新陈代谢。
与“下列叙述正确的是[ ]A.不同元素的根本区别在于其相对原子质...”考查相似的试题有:
- 在宏观、微观和符号之间建立联系是化学学科的特点。(1)在氧气、汞和氯化钠3种物质中,由离子构成的是 。(2)下图所示的2个...
- 下列各组物质,按混合物、化合物、单质顺序排列的是( )A.冰水共存物、二氧化硫、氮气B.石油、煤、天然气C.洁净的空气、...
- 据报道,一高校对东城河底淤泥的一项调查实验表明,底层沉积的淤泥中铅、镍、铬、锌等重金属含量,已经超过了城市的土壤的重...
- 生活中的下列物质属于纯净物的是( )A.牛奶B.碘酒C.雪碧D.蒸馏水
- (4分)下列物质中,属于混合物的是 (用序号填空,下同),属于单质的是 ,属于化合物的是 ,属于氧化物的是 ①糖水 ②冰水混合...
- 形态各异的物质可按一定规律分类.现有以下八种物质,请选用各物质名称前的字母序号填涂在答题卡相应位置.A.盐酸 B.氯化钾...
- (2013安徽)分类法是学习化学的一种方法。下列不属于分类方法的是A.物质可分为纯净物和混合物,纯净物又可分为单质和化合物...
- 在H、O、C、Na四种元素中,选择适当的元素组成符合下列要求的物质,并用该物质的化学式填空:(1)既有可燃性,又有还原性的...
- 下列各组中的物质化学式与俗名、名称均一致的是( )A.CaO、滑石粉、氧化钙B.NaOH、纯碱、氢氧化钠C.Na2CO3、苏打、碳酸钠...
- 某药品说明书中标明:本品每克含碘150mg、镁65mg、锌1.5mg、铜2mg、锰1mg,这里所标的各成分是指[ ]A.分子B.原子C.元素D....