本试题 “请将下列物质按照一定的要求从大到小(由多到少)排列(填序号).(1)相对分子质量:①二氧化碳 ②氢气 ③氮气______;(2)硫元素的化合价:①SO2②Na2SO4③H2S_...” 主要考查您对测容器—量筒
相对分子质量
化合价的求法
地壳中各种元素的含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测容器—量筒
- 相对分子质量
- 化合价的求法
- 地壳中各种元素的含量
概念:
量筒是用来量取液体的一种玻璃仪器。量筒是量度液体体积的仪器。规格以所能量度的最大容量(ml)表示,常用的有10ml、25ml、50ml、100ml、250ml、500ml、1000ml等。外壁刻度都是以ml为单位,10ml量简每小格表示0.2ml,而50ml量筒每小格表示1ml。可见量筒越大,管径越粗,其精确度越小,由视线的偏差所造成的读数误差也越大。所以,实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒。分次量取也能引起误差。如量取70ml液体,应选用100ml量筒。
量筒的使用:
(1)怎样把液体注入量筒?
向量筒里注入液体时,应用左手拿住量筒,使量筒略倾斜,右手拿试剂瓶,使量筒量筒瓶口紧挨着量筒口,使液体缓缓流入。待注入的量比所需要的量稍少时,把量筒放平,改用胶头滴管滴加到所需要的量。
(2)量筒的刻度应向哪边?
量筒没有“0”的刻度,一般起始刻度为总容积的1/10。不少化学书上的实验图,量筒的刻度面都背着人,这很不方便。因为视线要透过两层玻璃和液体,若液体是浑浊的,就更看不清刻度,而且刻度数字也不顺眼。所以刻度面对着人才好。
(3)什么时候读出所取液体的体积数?
注入液体后,等1~2分钟,使附着在内壁上的液体流下来,再读出刻度值。否则,读出的数值偏小。
(4)怎样读出所取液体的体积数?
应把量筒放在平整的桌面上,观察刻度时,视线与量筒内液体的凹液面的最低处保持水平,再读出所取液体的体积数。否则,读数会偏高或偏低。
(5)量筒能否加热或量取过热的液体?
量筒面的刻度是指温度在20℃时的体积数。温度升高,量筒发生热膨胀,容积会增大。由此可知,量筒是不能加热的,也不能用于量取过热的液体,更不能在量筒中进行化学反应或配制溶液。
(6)从量筒中倒出液体后是否要用水冲洗量筒?
这要看具体情况而定。如果仅仅是为了使测量准确,没有必要用水冲洗量筒,因为制造量筒时已经考虑到有残留液体这一点。相反,如果冲洗反而使所取体积偏大。如果要用同一量筒再量别的液体,就必须用水冲洗干净,为防止杂质的污染。 注:量筒一般只能用于精度要求不很严格时使用,通常应用于定性分析方面,一般不用于定量分析,因为量筒的误差较大。量筒一般不需估读,因为量筒是粗量器,但有时也需估读,如物理电学量器中的电流表,是否估读尚无定论。
(7)关于量筒仰视与俯视的问题:在看量筒的容积时是看水面的中心点,俯视时视线斜向下视线与筒壁的交点在水面上所以读到的数据偏高,实际量取溶液值偏低,仰视是视线斜向上视线与筒壁的交点在水面下所以读到的数据偏低,实际量取溶液值偏高。
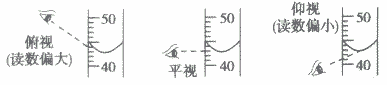
(8)量筒不能直接加热不能在量筒里进行化学反应不能在量筒里配制溶液的原因:
①量筒容积太小,不适宜进行反应
②不能在量筒内稀释或配制溶液,不能对量筒加热,所以不易配制溶液。
③不能在量筒里进行化学反应,以免对量筒产生伤害,有时甚至会发生危险。
④反应可能放热 注意:在量液体时,要根据所量的体积来选择大小恰当的量筒(否则会造成较大的误差),读数时应将量筒垂直平稳放在桌面上,并使量筒的刻度与量筒内的液体凹液面的最低点保持在同一水平面。一般来说量筒是直径越细越好,这样的精确度更高,因为圆形的面积只能计算粗略数,所以直径愈大,误差愈大。
(9)量筒的刻度是从几开始?
最低刻度通常来说是最大刻度的十分之一。比如最大刻度为10mL量筒标准最低刻度1mL,500mL的量筒则最低刻度应为50mL。
解题技巧:
(1)定物量液:是指对某一未知体积的液态物质用量筒量其体积。
例:要量出一杯酒精的体积。方法:
①选择大小合适的量筒。即选用体积略大于一杯酒精灯体积的量筒。
②将烧杯中的酒精倒入量筒中。
③将量筒放平,平视凹液向的最低点,读数即为这杯酒精的体积。若俯视,读数偏高;若仰视,则读数偏低。
(2)定量量液:是指用量筒量取一定体积的某液态物质。例:要量取80mL的水。方法:
①选择100mL的量筒。
②向量筒中倾倒水至接近80mL.刻度线时,改用胶头滴管滴加水至视线在同一水平线上,所量取水的体积即为80mL。若俯视读数,则实际量偏低;若仰视读数,则实际量偏高。
量筒是用来量取液体的一种玻璃仪器。量筒是量度液体体积的仪器。规格以所能量度的最大容量(ml)表示,常用的有10ml、25ml、50ml、100ml、250ml、500ml、1000ml等。外壁刻度都是以ml为单位,10ml量简每小格表示0.2ml,而50ml量筒每小格表示1ml。可见量筒越大,管径越粗,其精确度越小,由视线的偏差所造成的读数误差也越大。所以,实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒。分次量取也能引起误差。如量取70ml液体,应选用100ml量筒。
量筒的使用:
(1)怎样把液体注入量筒?
向量筒里注入液体时,应用左手拿住量筒,使量筒略倾斜,右手拿试剂瓶,使量筒量筒瓶口紧挨着量筒口,使液体缓缓流入。待注入的量比所需要的量稍少时,把量筒放平,改用胶头滴管滴加到所需要的量。
(2)量筒的刻度应向哪边?
量筒没有“0”的刻度,一般起始刻度为总容积的1/10。不少化学书上的实验图,量筒的刻度面都背着人,这很不方便。因为视线要透过两层玻璃和液体,若液体是浑浊的,就更看不清刻度,而且刻度数字也不顺眼。所以刻度面对着人才好。
(3)什么时候读出所取液体的体积数?
注入液体后,等1~2分钟,使附着在内壁上的液体流下来,再读出刻度值。否则,读出的数值偏小。
(4)怎样读出所取液体的体积数?
应把量筒放在平整的桌面上,观察刻度时,视线与量筒内液体的凹液面的最低处保持水平,再读出所取液体的体积数。否则,读数会偏高或偏低。
(5)量筒能否加热或量取过热的液体?
量筒面的刻度是指温度在20℃时的体积数。温度升高,量筒发生热膨胀,容积会增大。由此可知,量筒是不能加热的,也不能用于量取过热的液体,更不能在量筒中进行化学反应或配制溶液。
(6)从量筒中倒出液体后是否要用水冲洗量筒?
这要看具体情况而定。如果仅仅是为了使测量准确,没有必要用水冲洗量筒,因为制造量筒时已经考虑到有残留液体这一点。相反,如果冲洗反而使所取体积偏大。如果要用同一量筒再量别的液体,就必须用水冲洗干净,为防止杂质的污染。 注:量筒一般只能用于精度要求不很严格时使用,通常应用于定性分析方面,一般不用于定量分析,因为量筒的误差较大。量筒一般不需估读,因为量筒是粗量器,但有时也需估读,如物理电学量器中的电流表,是否估读尚无定论。
(7)关于量筒仰视与俯视的问题:在看量筒的容积时是看水面的中心点,俯视时视线斜向下视线与筒壁的交点在水面上所以读到的数据偏高,实际量取溶液值偏低,仰视是视线斜向上视线与筒壁的交点在水面下所以读到的数据偏低,实际量取溶液值偏高。
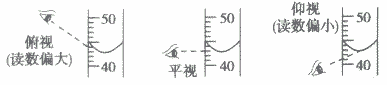
(8)量筒不能直接加热不能在量筒里进行化学反应不能在量筒里配制溶液的原因:
①量筒容积太小,不适宜进行反应
②不能在量筒内稀释或配制溶液,不能对量筒加热,所以不易配制溶液。
③不能在量筒里进行化学反应,以免对量筒产生伤害,有时甚至会发生危险。
④反应可能放热 注意:在量液体时,要根据所量的体积来选择大小恰当的量筒(否则会造成较大的误差),读数时应将量筒垂直平稳放在桌面上,并使量筒的刻度与量筒内的液体凹液面的最低点保持在同一水平面。一般来说量筒是直径越细越好,这样的精确度更高,因为圆形的面积只能计算粗略数,所以直径愈大,误差愈大。
(9)量筒的刻度是从几开始?
最低刻度通常来说是最大刻度的十分之一。比如最大刻度为10mL量筒标准最低刻度1mL,500mL的量筒则最低刻度应为50mL。
解题技巧:
(1)定物量液:是指对某一未知体积的液态物质用量筒量其体积。
例:要量出一杯酒精的体积。方法:
①选择大小合适的量筒。即选用体积略大于一杯酒精灯体积的量筒。
②将烧杯中的酒精倒入量筒中。
③将量筒放平,平视凹液向的最低点,读数即为这杯酒精的体积。若俯视,读数偏高;若仰视,则读数偏低。
(2)定量量液:是指用量筒量取一定体积的某液态物质。例:要量取80mL的水。方法:
①选择100mL的量筒。
②向量筒中倾倒水至接近80mL.刻度线时,改用胶头滴管滴加水至视线在同一水平线上,所量取水的体积即为80mL。若俯视读数,则实际量偏低;若仰视读数,则实际量偏高。
定义:
相对分子质量就是化学式中各原子的相对原子质量的总和,符号为Mr。如化学式为AmBn的物质的相对分子质量Mr=A的相对原子质量×m+B的相对原子质量×n。
易错易混点:
①化学式中原子团右下角的数字表示其个数(但BaSO4中的4表示氧原子的个数.不表示原子团 SO42-的个数),计算时先求一个原子团的相对质量,再乘以其个数。如Ca(OH)2的相对分子质量=40+(1+16)× 2=74;
②化学式中的圆点,如“CuSO4·5H2O”中的“·” 表示和,不表示积。即CuSO4·5H2O的相对分子质量CuSO4的相对分子质量+H2O的相对分子量×5=160+18×5=250;
③相对分子质量的单位为1,书写时省略不写;
④计算多个相同分子的相对分子质量总和时,应先求出化学式的相对分子质量再乘以前面的系数,如2KClO,的相对分子质量=2×(39+35.5+16×3) =245;
⑤若已知化合物中某原子的相对原子质量A和原了个数n及其质量分数x%,则化合物的相对分子质量=
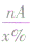
求化合价:
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
地壳中的元素分布:
地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,含量排在第二位至第五位的元素依次是硅、铝、铁、钙等。地壳中含量最高的非金属元素是氧元素;地壳中含量最高的金属元素是铝元素。(关键记清地壳中含量最高的前四位元素)
海水中元素分布:
海水中的元素分布海洋约占地球表面的70%左右,海水中的元素含量分布如下表所示。其中含量最多的是氧元素。其次是氢元素,这两种元素约占总量的96.5%。
人体中元素分布:
水占人体体重的70%左右。组成人体的元素中含最最多的是氧元索,其次是碳、氢、氮元素。碳,氢、氮三种元素在地壳中的含量较少,但却是生命的必需元素。
地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,含量排在第二位至第五位的元素依次是硅、铝、铁、钙等。地壳中含量最高的非金属元素是氧元素;地壳中含量最高的金属元素是铝元素。(关键记清地壳中含量最高的前四位元素)
海水中元素分布:
海水中的元素分布海洋约占地球表面的70%左右,海水中的元素含量分布如下表所示。其中含量最多的是氧元素。其次是氢元素,这两种元素约占总量的96.5%。
| 元素 | O | H | Cl | Na、Mg |
| 质量分数/% | 85.5 | 10.7 | 2.0 | 1.5 |
人体中元素分布:
水占人体体重的70%左右。组成人体的元素中含最最多的是氧元索,其次是碳、氢、氮元素。碳,氢、氮三种元素在地壳中的含量较少,但却是生命的必需元素。
| 元素 | O | C | H | N | Ca | P | S、K |
| 质量分数/% | 65 | 18 | 10 | 3 | 1.5 | 1.0 | 1.5 |
发现相似题
与“请将下列物质按照一定的要求从大到小(由多到少)排列(填序...”考查相似的试题有:
- 下列实验操作中,不正确的是( )A.实验完毕时用酒精灯盖盖灭酒精灯的火焰B.给液体加热时试管口不能对着自己和旁人C.点燃...
- 下列实验操作正确的是A.称取食盐B.稀释浓硫酸C.检查气密性D.点燃酒精灯
- 下列有关实验的叙述正确的是[ ]A.用10毫升量筒量取5.3毫升溶液B.用锌与浓盐酸反应来制取较纯氢气C.将浓氢氧化钠溶液保存在...
- (3分)规范的实验操作是实验成功的前提,请回答:(1)量取8mL稀硫酸,应选用______________mL的量筒。(2)胶头滴管用过后...
- 小李同学在学习了有关维生素的知识后,自制了一张《维生素C》知识小卡片,但不完整,请你帮他填写表中空格的内容.《维生素C...
- 只含铜和氧两种元素的固体样品9.0g,测得其中铜元素的质量为8.0g.已知铜的氧化物有CuO和Cu2O两种,下列说法正确的是( )A....
- 已知0℃和常压下的所有气体,当它们的质量(g)在数值上等于其相对分子质量时,其体积均约为22.4L。现有某化合物A中含有的元素不...
- 光导纤维是信息社会中不可缺少的高技术材料,其主要成分是二氧化硅.二氧化硅中硅元素的化合价为( )A.-2B.0C.+2D.+4
- 已知某化合物的化学式为Na2BeO2,则铍元素(Be)的化合价为( )A.+lB.+2C.+3D.+4
- 某化合物化学式为HnRO2n-1,若n=2时,R的化合价为______.