本试题 “工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中...” 主要考查您对氧化还原反应的本质和特征
氧化还原反应的定义
测定物质组成、成分含量
工业制硫酸
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的本质和特征
- 氧化还原反应的定义
- 测定物质组成、成分含量
- 工业制硫酸
电子的转移(得失或偏移)
氧化还原反应的特征:
化合价升降(某些元素化合价在反应前后发生变化,是氧化还原反应判别的依据)
氧化还原反应的发展史:
- 物质与氧气发生的反应属于氧化反应,含氧化合物中氧被夺去的反应属于还原反应。
- 有化合价升降的反应属于氧化还原反应。
- 有电子得失或偏移的反应属于氧化还原反应。
对物质的认识存在发展的过程,从最初的隔离开的氧化反应、还原反应,到从表面上看化合价变化的氧化还原反应,把氧化与还原统一在一个概念下,再透过现象看本质,化合价的变化是有电子得失或偏移引起的。
氧化还原反应中应注意的几个问题:
1、氧化剂氧化性的强弱,不是看得电子的多少,而是看得电子的难易;
还原剂还原性的强弱,不是看失电子的多少,而是看失电子的难易。
eg:氧化性:浓HNO3>稀HNO3还原性:Na>Al
2、有新单质参加或生成的反应不一定是氧化还原反应 eg:C(金刚石)==C(石墨);3O2==2O3(放电);P4(白磷)==4P(红磷)
3、任何元素在化学反应中,从游离态变为化合态,或由化合态变为游离态,均发生氧化还原反应(比如置换反应,化合反应,分解反应)
4、置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
5、元素具有最高价的化合物不一定具有强氧化性! eg.H3PO4、H2SiO3(或H4SiO4)两酸均无强氧化性但硝酸有强氧化性。
氧化还原的表示可用单线桥也可用双线桥:
一、双线桥法:
此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团。
标变价 明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
连双线 将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
标得失 1.标电子转移或偏离数 明确标出得失电子数,格式为“得/失发生氧化还原反应原子个数×单位原子得失电子数”
2.标化合价变化 一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
3.标出元素反应类型 一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒 检查得失电子数是否相等,如不相等则重新分析。
例如: 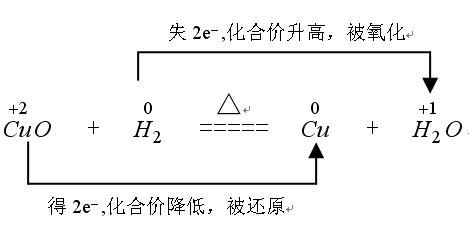
二、单线桥法:
在氧化还原反应中,有电子发生转移(得失或偏移),也就是在反应物中有元素电子发生得失或偏移,这时用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数,这种表示方法叫单线桥法。
(1)标价态明确标明发生氧化还原反应的元素的化合价
(2)连单线连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂
(3)不注得失标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数
例如: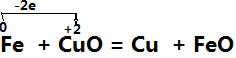
注意事项:
(1)不得标明"得"或"失",否则是错的
(2)箭头表示电子转移的方向,指向氧化剂注意:为了规范起见,单线桥法最好不用于自身氧化还原的反应,因为那样标记会使反应中的电子去向不明确,故在自身氧化还原的反应方程式中最好用双线桥法表示电子转移。
氧化还原反应:
有电子转移(得失或偏移)的反应;(无电子转移(得失或偏移)的反应为非氧化还原反应)
反应历程:
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
氧化还原反应中存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化还原性的强弱判定:
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
电子的得失过程:

其过程用核外电子排布变化情况可表示为:
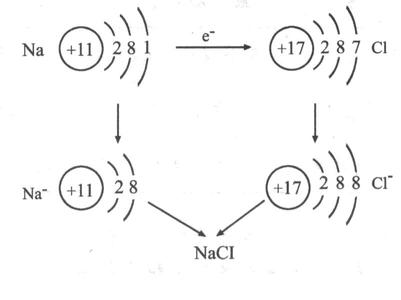
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
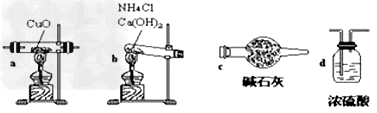
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
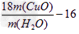
工业制硫酸的方法:
(1)硫铁矿制酸硫铁矿在沸腾焙烧炉内通空气燃烧产生SO2气体,经余热锅炉回收热量后,依次通过旋风除尘和电除尘进行干法除尘。随后,炉气再通过洗涤、冷却、除雾等一系列的净化操作进入干燥塔。干燥后的炉气用主鼓风机压送至一转一吸或两转两吸制酸装置内制取硫酸。其反应如下: 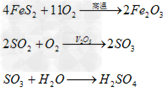
(2)硫磺制酸反应时生成的热传递给进入接触室的需要预热的浓和气体并冷却反应后生成的气体(即热交换过程)熔融硫磺在焚硫炉内用干燥空气燃烧产生SO2气体,经余热锅炉回收燃烧热后进入“一转一吸”或“两转两吸”制酸系统制取硫酸。其反应如下: 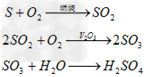
(3)冶炼烟气制酸主要利用有色金属铜、铅、锌、镍、钴等硫化矿在熔炼过程中产生的SO2烟气进行制酸。
其工艺流程除焙烧系统随有色金属硫化矿的焙烧工艺不同而有异外,其制酸工艺与沸腾炉炉气制酸相同。
硫酸的生产流程:
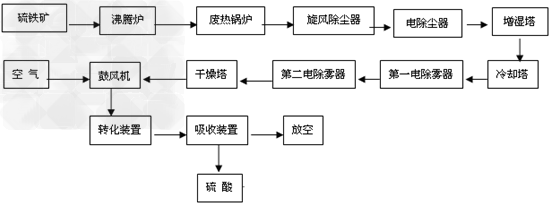
(1)原料工段原料处理能力要满足生产周转,与硫酸生产能力相匹配,能够满足焙烧工艺的进料工况条件结合矿源及工程,应着重考虑如下问题原料的卸车及转运方式、矿库的贮存能力(库容)、干燥及含尘尾气处理、块矿的破碎及筛分等。原料工段设置应尽量少进行固体物料的交叉,流程越简单越好。
(2)焙烧流程焙烧流程一般为:焙烧炉—废热锅炉—旋风除尘器—电除尘器,也可以不设旋风除尘器。这种流程非常紧凑,但电除尘器需专门设计且操作管理要求较高。为了尽可能使工艺技术和设备制造立足国内,增加装置操作的可靠性,使用国内的电除尘器,则倾向于设置旋风除尘器。一般采用增湿输送的干法排渣,有刮板输送机—冷却滚筒(增湿)一带式输送机流程和冷却滚筒+冷却滚筒(增湿)—带式输送机两种流程,目前设计倾向于使用后一种流程。
(3)净化流程大型硫酸装置选择酸洗净化流程。国内大型装置空塔流程居多,即空塔(增湿塔)—填料冷却塔(稀酸板式换热器)一两级电除雾器。近十多年来我国投产的硫铁矿制酸酸洗净化流程绝大多数使用此流程,亦是比较容易掌握的流程。近年来冶炼烟气制酸选择动力波洗涤器代替空塔居多,国内有关专家认为,动力波洗涤器特别适用于烟气量波动比较大的情况,效果较好,但压降较大,对气量均衡稳定的硫铁矿制酸并无明显优势。
(4)干吸流程干吸流程有塔槽一体化流程、三塔一槽流程、三塔两槽流程和三塔三槽流程。塔槽一体化即干燥塔、一吸塔、二吸塔均不设外部泵槽,由各塔的底部分别存液,循环泵设于塔外的管道上,国内比较典型的为贵州瓮福2×400kt/a硫铁矿制酸装置。塔槽一体化省去了泵槽和很多的管线,使得工艺流程简单、设备布置紧凑,有一定的优越性,但在设计时要考虑泵的密封,特别是一吸循环泵。目前,国内设计多采用三塔两槽流程,又以干燥塔一个循环槽.两吸收塔共用一个循环槽居多。干吸塔普遍使用不锈钢槽管式分酸器及大规格填料,可大幅增加分酸点,降低填料高度,优化塔的操作状况,提高塔的操作效率,塔的顶部装设高效除雾器。
(5)转化流程转化工序基本采用两转两吸流程,国内“2+2”,“3+2”,“3+1”几种流程都有,但目前采用较多的是,“3+1”流程,配套换热流程有ⅢⅠ—ⅣⅡ和ⅣⅠ—ⅢⅡ等,设计选择较多的ⅢⅠ—ⅣⅡ根据系统热平衡计算,可以考虑设置热管省煤器。转化系统的流程和设计参数的选择,实际上是系统的优化问题,需与所用催化剂和所用设备情况综合考虑,应尽量提高一转化的转化率,使尾气排放更容易达到日益严格的环保要求。
(6)生产硫酸流程图
与“工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,...”考查相似的试题有:
- 在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )A.2F2+2H2O=4HF+O2B.C+H2O △ . CO+H2C.2Na+2H2O=2NaOH+H2...
- 下列叙述正确的是( )A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原B.元素由化合态变成游离态时,它可能被...
- 对于反应3Cl2+6NaOH(液)=5NaCl+NaClO3+3H2O,下列说法不正确的是( )A.Cl2是氧化剂,也是还原剂B.NaCl是还原产物,NaClO...
- 下列各反应中,水作还原剂的是( )A.2H2+O2 点燃 . 2H2OB.2F2+2H2O═4HF+O2C.SO3+H2O═H2SO4D.2Na+2H2O═2NaOH+H2↑
- 下列叙述,不正确的是( )A.在3NO2+H2O=2HNO3+NO中,HNO3是氧化产物B.工业上接触法制硫酸流程中,涉及的反应都是氧化还原...
- 在4FeS2+11O2 煅烧 . 2Fe2O3+8SO2的反应中,被氧化的元素是( )A.Fe和SB.O和FeC.SD.Fe
- 下列反应中,氯元素被氧化的是( )A.2KClO3 MnO2 .△2KCl+3O2↑B.2P+5Cl2═2PCl5C.MnO2+4HCl(浓) △ . MnCl2+2H2O+Cl2↑D.H...
- 下列化学变化中需加入氧化剂才能实现的是( )A.Fe→FeCl2B.SO3→H2SO4C.CO2→COD.KMnO4→MnCl2
- 茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。【查阅部分资料:草...
- 下列有关化学实验的操作或者说法中,正确的是( )A.用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低B.配...