本试题 “图表是某地市场上销售的一种“加碘盐”包装袋上部分文字说明,请根据此表,结合学过的化学知识,回答下列问题:配料表精制海盐、碘酸钾(KIO3)含碘量20-40mg/k...” 主要考查您对化学元素和人体健康
单质和化合物
纯净物和混合物
物质组成元素的质量分数
物理性质和化学性质的区别和应用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学元素和人体健康
- 单质和化合物
- 纯净物和混合物
- 物质组成元素的质量分数
- 物理性质和化学性质的区别和应用
在人体中元素的存在形式:
①碳、氢、氧、氮主要以水、糖类、蛋白质、维生素和脂肪的形式存在。
②其他的元素主要以无机盐的形式存在于水溶液中。
③钙元素主要以羟基磷酸钙[Ca10(PO4)6(OH)2] 晶体的形式存在。
常量元素:
常量元素人体中含量较多的元素有11种,它们约占人体质量的99.95%。在人体中含量超过0.01%的元素,称为常量元素。
①人体中的常量元素
| 元素名称 | 元素符号 | 质量分数% |
| 氧 | O | 65.0 |
| 碳 | C | 18.0 |
| 氢 | H | 10.0 |
| 氮 | N | 3.0 |
| 钙 | Ca | 2.0 |
| 磷 | P | 1.0 |
| 钾 | K | 0.35 |
| 硫 | S | 0.25 |
| 钠 | Na | 0.15 |
| 氯 | Cl | 0.15 |
| 镁 | Mg | 0.05 |
②一些常量元素在人体中的作用及每天适宜摄入量
| 钙 | 使骨骼和牙街具有坚硬的结构支架 | 800—1200mg | 缺钙主要影响骨骼的发育和结构,临床症状表现为青少年的佝偻病和成年人的骨质软化症及老年人的骨质疏松症。钙是无毒的元素,但摄入过量会导致高血钙,从而引起消化系统、泌尿系统等的疾病 | 海产品、豆类、奶类、各种绿叶蔬菜等 | 其中99%存在于骨骼和牙齿中,主要以羟基磷酸钙 [Ca10(PO4)6(OH)2晶体的形式存在 |
| 钠 | 细胞外液和细胞内液中的Na+和K+各自保持一定的浓度,维持人体内的水分和体液恒定的pH | 2000—2500mg | 缺钠会引起肌肉痉挛、头痛等;过量会引起水肿、高血压、贫血等 | 食盐 | 其中一半以Na+的形式存在于细胞外液中 |
| 钾 | 1850—5600mg | 缺钾会引起肌肉不发达、心律小齐等;过量会导致恶心、腹泻等 | 香蕉、柑橘、橙子、山楂、蘑菇、豆炎及其制品等 | 主要以K+的形式萍在干细胞内液中 | |
| 镁 | 促进骨骼发育、细胞遗传物质合成等 | 300—400mg | 缺镁会引起肌肉不发达、抽搐、痉挛、心律不齐等;过量会引起神经系统紊乱、肾病等 | 坚果、大豆、牛奶等 | 70%的镁以磷酸盐和碳酸盐形式参与骨骼和牙齿的组成,25%的镁存在于软组织中 |
微量元素:
在人体中含量在0.01%以下的元素。
①一些人体必需的微量元素
| 元素名称 | 元素符号 |
| 铁 | Fe |
| 钴 | Co |
| 铜 | Cu |
| 锌 | Zn |
| 铬 | Cr |
| 锰 | Mn |
| 钼 | Mo |
| 氟 | F |
| 碘 | I |
| 硒 | Se |
②一些必需微量元素对人体的作用及14—18岁人群每天的适宜摄入量
| 元素 | 人体内的含量 | 对人体的作用 | 适宜摄入量(每天) | 摄入量过高,过低对人体健康的影响 |
| 铁 | 4—5g | 是血红蛋白的成分,能帮助氧气的运输 | 20—50mg | 缺铁会引起贫血 |
| 锌 | 2.5g | 影响人体发育 | 15.5—19mg | 缺锌会引起食欲不振,生长迟缓,发育不良 |
| 硒 | 14—21mg | 有防癌、抗癌作用 | 50μg | 缺硒可能引起表皮角质化和癌症。如摄入量过高,会使人中毒 |
| 碘 | 25—50mg | 是甲状腺激素的重要成分 | 150μg | 缺碘会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝。过量也会引起甲状腺肿大 |
| 氟 | 2.6g | 能防治龋齿 | 1.5mg | 缺氟易产生龋齿,过量会引起氟斑牙和氟骨病 |
知识拓展:
如果人体所需的元素仅从食物中摄取还不足时,可通过食品添加剂和保健药剂来予以补充。
如在食品巾添加含钙、锌、硒、锗的化合物,或制成补钙、补锌等的保健药剂或制成加碘食盐,来增加对这些元素的摄人量。但要注意即使是人体必需的元素,也要注意适宜的摄入量,摄人量过高和过低对人体健康都有不良的影响。
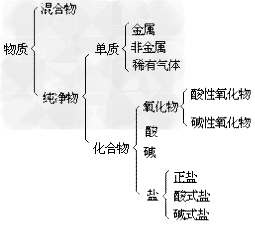
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
| 单质 | 化合物 | ||
| 区别 | 宏观组成 | 同种元素 | 不同种元素 |
| 微观构成 | 有同种原子构成 | 由不同种原子构成 | |
| 化学性质 | 不能发生分解反应 | 一定条件下发生分解反应 | |
| 联系 | 相互转变 | 它们均属于纯净物。单质发生化合反应可以生成化合物,化合物发生分解反应可以生成单质 | |
| 质子数 | 同一种元素的原子,不论在一单质里还是在化合物里,原子核内质子数保持不变 | ||
化合物与氧化物的区别和联系:
| 化合物 | 氧化物 | |
| 区别 | ①由不同种元素组成的纯净物叫化合物 ②由两种或两种以上元素组成 ③不一定含有氧元素 ④属于纯净物中的一类 |
①由两种元素组成的化合物中,如果有一种元素是氧元素,这种化合物叫氧化物 ②一定由两种元素组成 ③一定含有氧元素 ④属于化合物中的一类 |
| 联系 | 氧化物和化合物是个体与总体的关系,氧化物属于化合物中的一类 | |
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
共价化合物与离子化合物的区别:
1. 共价化合物
(1)概念:像HCl、CO2这样以共用电子对结合在一起的化合物为共价化合物。
(2)共价化合物的类型:
①两种非金属原子结合成的化合物,如HCl、CO2等。
②非金属与酸根构成的化合物,如H2SO4、HNO3等。
2. 离子化合物与共价化合物的区别:
离子化合物是由阴、阳离子相互作用形成的化合物;共价化合物是原子间全部以共用电子对结合形成的化合物。离子化合物由离子构成,共价化合物大多数由分子构成。
混合物:
(1)概念:由两种或多种物质混合而成的物质,没有有固定的组成,各成分保持自己原有的化学性质。
(3)常见的混合物:空气、合金、矿石、溶液等。
(4)混合物的提纯:混合物经过物理或化学的方法可以提纯。
纯净物:
(1)概念:只由一种物质组成的物质。
(3)纯净物的分类:纯净物根据物质组成的元素种类,分为两大类:单质和化合物。
纯净物和氧化物的区别:
| 纯净物 | 混合物 | |
| 概念 | 宏观:由一种物质组成的物质 微观:由同种分子构成(对于由分子构成的物质而言) |
宏观:由两种或多种物质组成的物质 微观:由不同种分子构成(对于由分子构成的物质而言) |
| 区别 | 由同种物质组成(对于由分子构成的物质,是由同种分子构成的),组成是固定的 | 由不同种物质组成(对于由分子构成的物质. 是由不同种分子构成的),组成是不固定的 |
| 特点 | ①具有固定的组成 ②具有一定的性质 ③有专门的化学符号 |
①没有固定的组成和性质 ②各成分保持各自的性质 ③没有专门的化学符号 |
| 分离方法 | 组成固定,不需分离;若需将化合物分成几种单质,则必须通过化学方法才能实现 | 物理方法: 筛选 过滤 蒸馏 |
| 实例 | 氧气,二氧化碳,高锰酸钾 | 空气,粗盐,蔗糖水 |
| 联系 | 纯净物是相对而言的,自然界中绝对纯净的物质是不存在的,通常的纯净物是指含杂质很少的具有高纯度的物质。两者间的关系为 | |
对纯净物和混合物概念的理解:
(1)混合物概念:混合物可以看作是由几种纯净物混合而成的,混合物的形成过程中发生的是物理变化。由于混合物的组成一般不固定,所以往往不能用化学式表示。
(2)纯净物概念:纯净物只由一种物质组成,有固定的组成.可以用化学式表示。
常考的纯净物与混合物:
(1)混合物:石油、煤、天然气、洁净的空气、生理盐水、矿泉水、汽水、碘酒、白酒、双氧水、盐酸、合金等都是混合物。
(2)纯净物:水银、烧碱、纯碱、胆矾、液态氧、液态氮、蒸馏水(纯水)、干冰、冰水共存物、金刚石、石墨、生石灰、熟石灰、氯化钠、氧化铁等都是纯净物:
物质的分类示意图:
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=

如AmBn中A元素的质量分数=

若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=
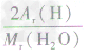 ×100%=
×100%=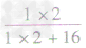 ×100%=
×100%=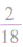 ×100%=11.1%而不能写成
×100%=11.1%而不能写成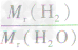 ×100%=
×100%=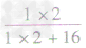 ×100%=
×100%=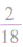 ×100%=11.1%
×100%=11.1%化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例:
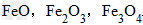 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?解析:三种含铁的氧化物的化学式可变形为
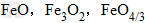 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: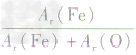 、
、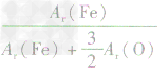 、
、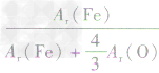 ,通过比较分母可知:
,通过比较分母可知: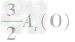 >
>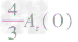 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。物理性质:
1. 概念: 不需要发生化学变化就直接表现出来的性质。
2. 实例:在通常状态下,氧气是一种无色,无味的气体。
3. 物质的物理性质:如颜色,状态,气味,熔点,沸点,硬度等。
化学性质:
1. 概念:物质在化学变化中表现出来的性质,如铁在潮湿的空气中生成铁锈,铜能在潮湿的空气中生成铜绿。化学性质只能通过化学变化表现出来。
物质的性质和用途的关系:
若在使用物质的过程中,物质本身没有变化,则是利用了物质的物理变化,物质本身发生了变化,变成了其他物质,则是利用了物质的化学性质。物质的性质与用途的关系:物质的性质是决定物质用途的主要因素,物质的用途体现物质的性质。
物质的性质与物质的变化的区别和联系
| 物质的性质 | 物质的变化 | |
| 区别 | 物质的性质是指物质的特有属性,不同的物质其属性不同,是变化的内因 | 物质的变化是一个过程,是有序的,动态的,性质的具体体现 |
| 联系 | 物质的性质决定了它能发生的变化,而变化又是性质的具体表现 | |
判断是“性质”还是“变化”:
判断某种叙述是指物质的“性质”还是“变化”时,首先要准确把握它们的区别和联系,若叙述中有“能”,“难”,“易”,“会”,“就”等词语,往往指性质,若叙述中有“已经”,“了”,“在”等词语,往往指物质的变化。
有关描述物质的词语:
1. 物理性质:
(1)熔点
物质从固态变成液态叫熔化,物体开始熔化时的温度叫熔点。
(2)沸点
液体沸腾时的温度叫沸点。
(3)压强
物体在单位面积上所受到的压力叫压强。
(4)密度
物质在单位体积上的质量叫密度,符号为p。
(5)溶解性
一种物质溶解在另一种物质里的能力,称为这种物质的溶解性。溶解性跟溶质、溶剂的性质及温度等因素有关。
(6)潮解
物质在空气中吸收水分,表面潮湿并逐渐溶解的现象。如固体、NaOH,精盐在空气中易潮解。
(7)挥发性
物质由固态或液态变为气体或蒸气的过程二如浓盐酸具有挥发性,可挥发出氯化氢气体
(8)导电性
物体传导电流的能力叫导电性:固体导电靠的是白由移动的电子,溶液导电依靠的是自由移动的离子
(9)导热性
物体传导热量的能力叫导热性。一般导电性好的材料,其导热性也好。
(10)延展性
物体在外力作用下能延伸成细丝的性质叫延性;在外力作用下能碾成薄片的性质叫展性。二者合称为延展性,延展性一般是金属的物理性质之一。
2. 化学性质:
(1)助燃性物质在一定的条件下能进行燃烧的性质。如硫具有可燃性。
(2)助燃性物质能够支持燃烧的性质。如氧气具有助燃性
(3)氧化性在氧化还原反应中,能够提供氧元素的性质
(4)还原性在氧化还原反应中,能够夺取含氧化合物中氧元素的性质,初中化学常见的还原性物质(即还原剂)有 H2、CO、C。
(5)酸碱性酸碱性是指物质能够使酸碱指示剂变色的性质: 酸性溶液能使紫色石蕊变红,碱性溶液能使紫色石蕊变蓝。
(6)稳定性物质不易与其他物质发生化学反应或自身不易发生分解反应的性质,如稀有气体化学性质稳定。
(7)风化结晶水合物(如Na2CO3·10H2O)在干燥的环境中失去结晶水的性质。
与“图表是某地市场上销售的一种“加碘盐”包装袋上部分文字说明,...”考查相似的试题有:
- 现有①氧气、②氢气、③矿泉水、④空气、⑤镁条、⑥二氧化碳、⑦氢氧化钠(NaOH)、⑧铁八种物质,其中属于混合物的是______;属于单...
- 下列说法正确的是[ ]A.由一种元素组成的物质一定是单质B.任何纯净物都是由一种元素组成C.含有氧元素的化合物一定是氧化物D...
- 氯气溶于水可形成氯水。氯水中含有Cl2、H2O、HClO……等微粒。下列有关氯水及其成分的说法错误的是[ ]A.氯水是混合物B.Cl2属...
- 在宏观、微观和符号之间建立联系是化学学科的特点。甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于下表...
- 2011年3月11日日本发生的9.0级强震,导致福山核电站出现严重的核危机。核能已经成为一种重要且风险性很大的能源,氘和氚都是...
- 豆浆被称为“植物奶”,其中含有的异黄酮(C15H10O2)具有防癌功能.下列关于异黄酮的说法正确的是( )A.异黄酮中共含有27个...
- 如图是“××化工集团”生产的袋装化肥的外包装图.试计算:(1)碳酸氢铵(NH4HCO3)的相对分子质量是______;(2)一袋该化肥中...
- 如图是某化学反应的微观示意图,其中不同的圆球代表不同原子。下列说法中正确的是A.该反应涉及到四种原子B.该反应属于置换...
- 右图是某反应的微观示意图,下列说法错误的是( )A.反应物中有单质和化合物B.反应前后原子个数和元素种类都不变C.参加反...
- 下列物质的用途与其化学性质相关的A.用铝作导线B.用金刚石切割玻璃C.干冰做制冷剂D.用氮气作食品包装袋的填充气