本试题 “某学生利用以下装置探究纯净干燥的氯气与氨气之间的反应.回答下列问题:(1)根据下列所给试剂,选择制取氨气的装置是(填对应字母)______;写出制备氯气的...” 主要考查您对氯气
氯气的制取
氨气的制取
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯气
- 氯气的制取
- 氨气的制取
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: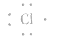
④氯的原子结构示意图: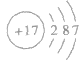
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 氯气的实验室制法:
(1)实验室用浓盐酸和二氧化锰反应制取氯气。 
(2)装置图: 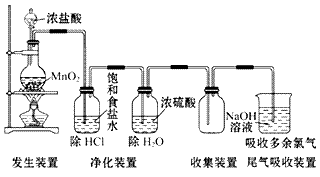
(3) 步骤: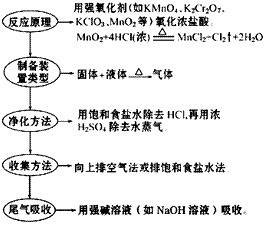

氯气的工业制法:
(1)电解饱和食盐水(氯碱工业),化学方程式为: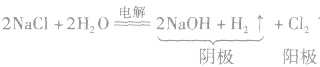
(2)电解熔融的氯化钠(可制得金属蚋),化学方程式为:
(3)电解熔融的氯化镁(可制得金属镁),化学方程式为:
(1)实验室用氢氧化钙和氯化铵制取氨气
2NH4Cl+Ca(OH)2 CaCl2+2NH3+2H2O
CaCl2+2NH3+2H2O
(2)仪器:铁架台,铁夹,酒精灯,两个大试管,棉花;氯化铵固体,氢氧化钙固体。
(3)装置图: 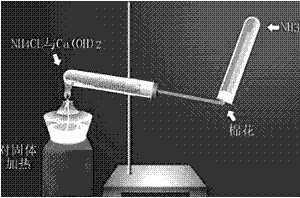
(4)注意:
a. 一般用Ca(OH)2,而不用NaOH,因NaOH碱性太强,对大试管腐蚀比Ca(OH)2强。
b. 选用Ca(OH)2时要检验消石灰是否变质, 因经过长期存放后消石灰部分变成碳酸钙,最好用新制的消石灰。
c. NH4CL与Ca(OH)2质量比5:8为宜,如用(NH4)2SO4代替NH4CL,则质量比为1:1,消石灰过量,以防止生成氨合物。
d. 试管口(盛固体药品的试管)要略向下倾斜;
e. 固体药品要平铺试管底部;
f.导出氨气的导管要短,收集氨气的导管要长,伸入试管底部;
g.为使氨气收集更多,防止空气中的水蒸汽进入收集氨气的试管,在试管口防一块,但不能堵死
h.酒精灯加热用外焰,先均匀加热,后对固体加热。
(5)收集方法: 用向下排气法取气法收集。因氨气极易溶于水,比空气轻。
干燥氨气: 用碱石灰,不能用浓硫酸和氯化钙干燥氨气。
检验氨气:用湿润的红色石蕊试纸,氨气能使湿润的红色石蕊试纸变蓝。
发现相似题
与“某学生利用以下装置探究纯净干燥的氯气与氨气之间的反应.回...”考查相似的试题有:
- 下列说法正确的是[ ]A.Cl2和SO2的漂白原理不同,混合使用效果更好B.测定等浓度的CH3COONa和NaCN溶液的pH分别为8.8和11.1,...
- 次氯酸钠能有效地杀灭水中的细菌和病毒。该过程不可能涉及的变化有A.置换反应B.复分解反应C.电离D.水解
- (11分)氯气和氨气在常温下混合即可发生反应。某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置:请回答...
- (8分)欲用密度为1.18g/cm3(质量分数36.5%)的浓盐酸配制250mL1mol/L盐酸,回答下列各问:(1)所需浓盐酸体积约为_______mL(...
- 下列叙述中,不正确的是( )A.氯气能溶解于水B.氯气是一种有毒气体C.氯气、液氯和氯水是同一种物质D.氯气是一种黄绿色、...
- 水是生命之源,也是化学反应中的主角。试回答下列问题:(1)A、B、C是中学化学常见的三种有色物质(其组成元素均属于短周期元...
- 用如图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:(1)图中D装置在实验中的作用___________...
- (12分)实验室需要480 mL 0.4 mol·L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解.②...
- 光卤石是化工生产中一种重要的中间产物,其化学成分是KCl·MgCl2·6H2O。当用光卤石为原料制取金属镁时,一共有下列几步:①过滤...
- Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如下图...