本试题 “下列物质的化学用语正确的是( )A.NH4H的电子式:B.硝基苯的结构简式:C.甲烷分子的比例模型:D.sp2杂化轨道模型:” 主要考查您对杂化轨道理论(中心原子杂化方式)
电子式的书写
结构简式
比例模型
球棍模型
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
- 电子式的书写
- 结构简式
- 比例模型
- 球棍模型
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
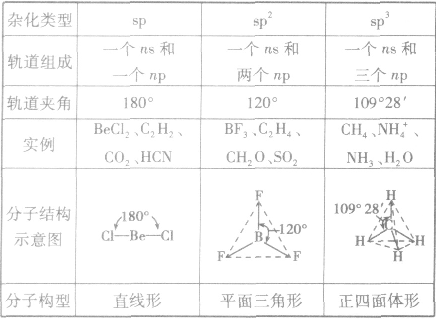
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、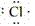
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、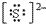
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: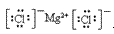 、
、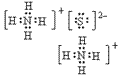
(5)共价化合物的电子式:画出离子最外层电子数: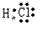 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: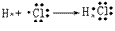
氯化镁的形成过程: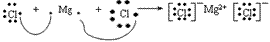
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: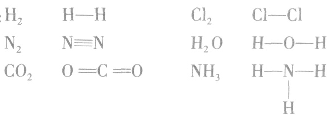
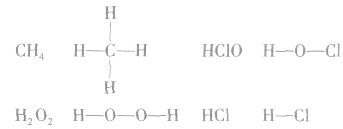
书写电子式的常见错误:
1.漏写未参与成键的电子,如: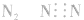
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: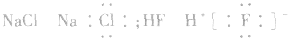
3.书写不规范,错写共用电子对如:N2的电子式为: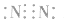 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: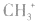 的电子式为
的电子式为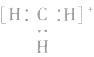 ,而非
,而非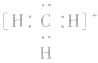 , 因
, 因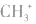 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: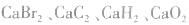 中
中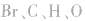 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: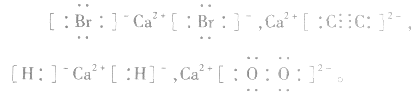
结构式的简便写法,着重突出结构特点(官能团),如CH3-CH3,CH2=CH2
用不同体积的小球表示不同原子的大小,如:

小球表示原子;短棍表示价键,如:
与“下列物质的化学用语正确的是( )A.NH4H的电子式:B.硝基苯...”考查相似的试题有:
- A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外共有两对成对电子,且电子总数是E原子总数的1/2;...
- 下列表示物质结构的化学用语或模型图正确的是( ) A.H2O2的电子式: B.O2-的结构示意图: C.聚氯乙烯的结构简式: D.丙...
- 有关化学用语正确的是( )A.乙烯的结构简式CH2CH2B.乙醇的结构简式C2H6OC.四氯化碳的电子式D.乙酸的分子式C2H4O2
- 原子序数从小到大排列的四种短周期元素W、X、Y、Z,四种元素的原子最外层电子数之和等于12,W是原子半径最小的元素;由X、Y元...
- 重氮甲烷(CH2N2)能与酸性物质反应:R-COOH+CH2N2→R-COOCH3+N2。下列物质中能与重氮甲烷反应但产物不是酯的是A.HCHOB.C6H5...
- 一种塑料抗氧化剂C可通过下列反应合成:下列有关叙述正确的是A.物质A中所有碳原子有可能位于同一平面B.物质B不能发生取代反...
- 还原性染料是靛蓝的结构简式如图所示,下列关于靛蓝的叙述中错误的 A.靛蓝由碳、氢、氧、氮四种元素组成B.它的分子式是C16H...
- 下列有机分子中,所有的原子不可能处于同一平面的是( )A.CH2=CH-CN;B.CH2=CH-CH=CH2;C.;D.;
- 分子式为C7H14O2的有机物Q,在稀硫酸中经加热可转化为乙醇与一种酸性物质,则Q的结构最多有 ( )。A.6种B.4种C.3种D.2种
- 胡妥油(D)用作香料的原料,它可由A合成得到:下列说法正确的是A.若有机物A是由异戊二烯和丙烯酸加热得到的,则该反应的反...