本试题 “X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,相关信息如下表根据上述信息回答下列问题:(1)元素Q在周期表中的位置:__________。(2)Z的离子结构示意图...” 主要考查您对过氧化钠
氨气
过氧化氢
元素周期表
元素的推断
离子结构示意图
盖斯定律
结构式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 过氧化钠
- 氨气
- 过氧化氢
- 元素周期表
- 元素的推断
- 离子结构示意图
- 盖斯定律
- 结构式
过氧化钠(Na2O2)的基本性质:
淡黄色固体,较稳定,可用作供氧剂、漂白剂
(1)与水反应:2Na2O2+2H2O==4NaOH+O2↑
(2)与CO2反应:2Na2O2+2CO2==2Na2CO3+ O2
(3)与HCl反应:2Na2O2+4HCl==4NaCl+2H2O+ O2↑
过氧化钠的特性及计算:
1.过氧化钠的强氧化性
2.Na2O2与CO2、H2O(g)反应的重要关系
(1)气体体积差的关系
2Na2O2+2CO2===2Na2CO3+O2 气体体积差 ①
2 1 ΔV=1
2Na2O2+2H2O(g)===4NaOH+O2 气体体积差 ②
2 1 ΔV=1
由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,即为生成氧气的量。
(2)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
(3)电子转移关系
当Na2O2与CO2或H2O反应时,每产生1molO2就转移2mol电子。
(4)固体质量变化关系
①足量过氧化钠与水、CO2反应的计算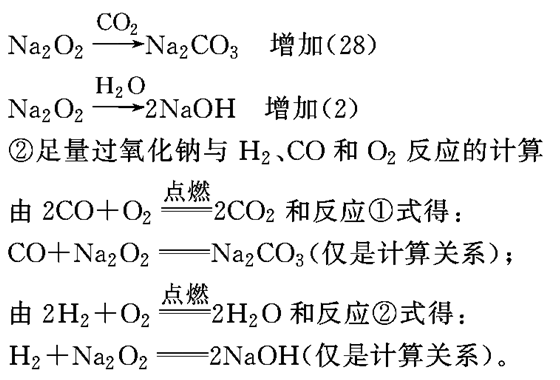
所以,有ag通式符合(CO)m(H2)n(m=0,1,2,3…,n=0,1,2,3…)的物质(包括纯净物和混合物)在氧气中燃烧,将其通过足量过氧化钠,反应完毕后,固体增重ag。
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 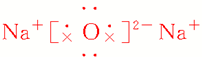 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
特别提醒:
(1)用脱脂棉包裹住过氧化钠,滴加少量水时脱脂棉可以燃烧,不仅可以说明Na2O2与H2O反应生成O2,还可以说明该反应放热。
(2)Na2O2与H2O反应时H2O既不是氧化剂也不是还原剂。
方法技巧:Na2O与Na2O2的结构与性质
(1)Na2O中只含离子键,Na2O2中既含离子键,又含非极性键。
(2)等物质的量的Na2O与Na2O2分别于等量且足量的H2O反应,所得溶液的成分浓度相同
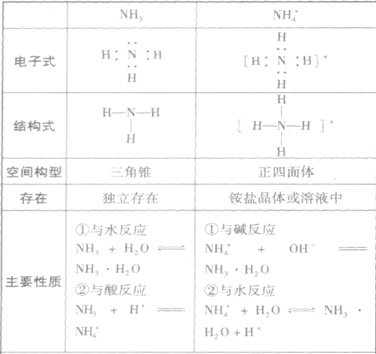
氨:
NH3的电子式为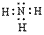 ,结构式为
,结构式为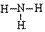 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为: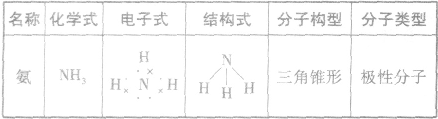
氨的物理性质和化学性质:
1.物理性质:
氨是无色、有刺激性气味的气体,比空气轻;氨易液化,在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热。液态氨气化时要吸收大量的热,使周围的温度急剧下降;氨气极易溶于水,在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);氨对人的眼、鼻、喉等粘膜有刺激作用,若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
2.化学性质:
(1)与水反应, ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。
(2)与酸反应生成铵盐反应实质为:
反应原理拓展NH3分子中N原子有一对孤电子,能够跟有空轨道的H+形成配位键: 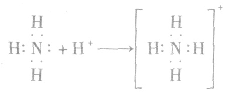
(3)具有还原性  (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
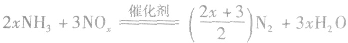 (治理氮氧化物污染)
(治理氮氧化物污染)
(4)与CO2反应制尿素 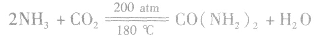
(5)配合反应
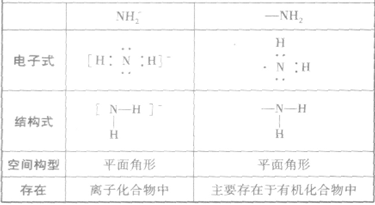
 的比较:
的比较:
氨的结构与性质的关系总结:

氨的用途:
(1)氨是氮肥工业及制造硝酸、铵盐、纯碱等的重要原料。
(2)氨也是有机合成工业(如制尿素、合成纤维、染料等)上的常用原料。
(3)氨还可用作制冷剂。
对实验室制氨气常见问题的解释:
l.制取氨气时为什么用的铵盐一般是氯化铵而不是硝铵、硫铵或碳铵实验室制氨气用 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为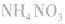 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应: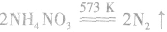
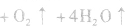 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用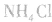 。
。
2.不用铵盐与强碱反应能否制取氨气能。
①加热浓度在20%以上的浓氨水,若浓度不够可加人适量固体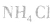 和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 
②将浓氨水滴入盛有固体烧碱或生石灰(CaO)的烧瓶中,使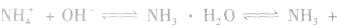
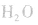 平衡右移,放出
平衡右移,放出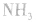 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低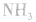 ,在水中的溶解度。
,在水中的溶解度。
③将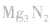 溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 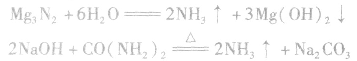
3.为什么制NH3用Ca(OH)2而不用NaOH ①固体NaOH易吸湿结块,不易与铵盐混合充分而反应;②在加热条件下,NaOH易腐蚀玻璃仪器。
4.制NH3的装置有哪些注意事项
①收集装置和发生装置的试管和导管必须是干燥的,因为氨气易溶于水;
②发生装置的试管口略向下倾斜,以免生成的水倒流使试管炸裂;
③导管应插入收集装置的底部,以排尽装置中的空气;
④收集NH3的试管口塞一团棉花,作用是防止NH3与空气形成对流,使收集的NH3较纯,还可防止NH3逸散到空气中。
5.用什么方法收集NH3只能用向下排空气法,因为NH3极易溶于水,密度又比空气小。
6.怎样收集干燥的NH3将NH3通过盛有碱石灰或固体NaOH的干燥管,但不能选用浓 、无水
、无水 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。
7.怎样检验NH3已充满试管把湿润的红色石蕊试纸放在试管口处,若试纸变蓝,则NH3已充满;把蘸有浓盐酸的玻璃棒接近试管口,若产生大量白烟,则NH3已充满。
过氧化氢:
俗称,双氧水,基本结构为H-O-O-H,但并不是直线结构,因此有极性,是极性分子;O上有孤电子对,因此O-O键很弱易断。
过氧化氢和水的性质比较:


元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
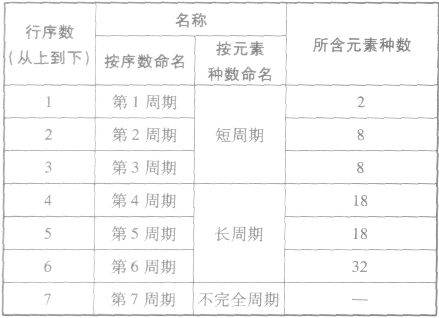
(2)族
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
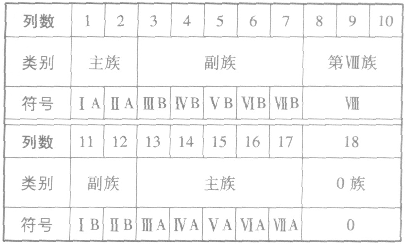
(3)元素周期表中主族元素金属性和非金属性的递变
元素性质推断知识点归纳:
(1)质量最轻的元素是氢(H),其单质可以填充气球;质量最轻的金属是锂(Li);熔点最高的非金属单质是石墨;熔点最高的金属单质是钨(W);熔点最低的金属单质是汞(Hg)。
(2)地壳中含量最多是氧(O),其次是Si、Al、Fe、Ca、Na、K、Mg、H、Ti。
(3)既难得电子,又难失电子且为单原子分子的气体是稀有气体。
(4)最高正价与最低负价绝对值之差为4的是硫(S);最高正价与最低负价绝对值之差为零的是碳(C)和硅(Si)。
(5)碳(C)是形成化合物最多的元素,是构成有机物的骨架元素,可形成多种同素异形体,其中硬度最大的是金刚石,而C60是分子晶体,熔点较低。
(6)常温下能与水反应放出氧气,单质是氟(F2),化合物是过氧化钠(Na2O2)。
(7)硅(Si)是构成地壳岩石骨架的主要元素,单质硅可被强碱溶液腐蚀且能放出氢气,还能被弱酸氢氟酸所溶解。
(8)能在空气中自然的非金属单质是白磷(P4),白磷有毒,能溶于CS2,和红磷互为同素异形体,红磷不能自然,不溶于CS2,白磷与红磷在一定的条件下可以相互转化。
(9)既能在二氧化碳中燃烧,又能在氮气中燃烧的金属是Mg,既能与酸溶液又能与碱溶液作用且均放出氢气的金属是铝(Al)。
(10)同一元素的气态氢化物和最高价氧化物的水化物化合生成盐的元素一定是氮(N)。
(11)同一元素的气态氢化物和气态氧化物反应生成该元素得单质和水,该元素可能是氮(N)或硫(S)。
(12)光照时可以释放电子的是铷(Rb)和铯(Cs);常温下呈液态的金属是汞(Hg),非金属单质是溴(Br2)。
解元素推断题必备知识归纳
(1)与元素的原子结构相关知识归纳
①最外层电子数等于次外层电子数的元素是Be、Ar;最外层电子数是次外层电子数2倍的元素有C;最外层电子数是次外层电子数3倍的元素有O;最外层电子数是次外层电子数4倍的元素有Ne。
②次外层电子数是最外层电子数2倍的元素有Li、Si;次外层电子数是最外层电子数4倍的元素有Mg。
③内层电子数是最外层电子数2倍的元素有Li、P;电子总数是最外层电子数2倍的元素有Be。原子核内无中子的元素是11H。
④常见等电子微粒:
|
电子数 |
分子 |
阳离子 |
阴离子 |
|
2 |
H2、He |
Li+、Be2+ |
H- |
|
10 |
Ne、HF、H2O、NH3、CH4 |
Na+、Mg2+、Al3+、H3O+、NH4+ | O2-、F-、OH-、NH2- |
|
18 |
Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4、C2H6、CH3OH |
K+、Ca2+ |
S2-、HS-、Cl- |
①主族序数与周期序数相同的元素有H、Be、Al;主族序数是周期序数2倍的元素有C、S;主族序数是周期序数3倍的元素有O。
②周期序数是主族序数2倍的元素有Li、Ca;周期序数是主族序数3倍的元素有Na。
③最高正价与最低负价的绝对值相等的元素有C、Si;最高正价是最低负价的绝对值3倍的元素有S。
④上一周期元素所形成的阴离子和下一周期元素最高价态阳离子的电子层结构与上一周期零族元素原子的电子层结构相同。
(3)与元素性质相关知识归纳
①元素所形成的单质及化合物的物理特性
A.颜色:常温下,单质为有色气体的元素是F、Cl;单质为淡黄色固体的元素是S;焰色反应火焰呈黄色的元素是Na,呈紫色的元素是K(通过兰色钴玻璃)。
B.状态:常温下,单质呈液态的非金属元素是Br;单质为白色蜡状固体的元素是P。
C.气味:有臭鸡蛋气味的非金属元素是S。
D.熔点:单质熔点最低的金属元素是Hg;熔点最高的金属元素是W。单质熔点最高的非金属元素是C。氢化物熔点最高的非金属元素是O。氧化物熔点最高的非金属元素是Si。
E.硬度:单质为天然物质中硬度最大的元素是C。
F.密度:单质最轻的金属元素是Li;单质最轻的非金属元素是H。
G.溶解性:气态氢化物最易溶于水的元素是N。
H.导电性:单质能导电的非金属元素是C;单质属于半导体材料的是Si。
②元素所形成的单质及化合物的化学特性
A.无正价、无含氧酸的元素是F;单质氧化性最强、其氢化物水溶液可雕刻玻璃的元素是F;气态氢化物稳定性最强的元素是F;最高价氧化物对应的水化物酸性最强的元素是Cl。
B.其两种同素异形体对人类生存都非常重要的元素是O(O3层被称为人类和生物的保护伞);气态氢化物与最低价氧化物能反应生成单质的是S。
C.气态氢化物与最高价氧化物对应水化物能起化合反应的元素是N;气态氢化物能使湿润的红色石蕊试纸变蓝的元素是N;其中一种同素异形体在空气中能自燃的元素是P。
③元素性质递变规律
A.元素金属性强弱比较规律
I.依据元素周期表,同一周期中,从左到右,金属性逐渐减弱;同一主族中,由上到下,金属性逐渐增强。
II.依据最高价氧化物的水化物碱性强弱,碱性越强,金属性越强。
III.依据金属活动性顺序(极少数例外)。
IV.依据金属单质与酸或水反应的剧烈程度,反应越剧烈,金属性越强。
V.依据金属单质与盐溶液之间的置换反应。
VI.依据原电池原理,原电池中作负极的金属比作正极的金属金属性强。
VII.依据电解原理,电解时,阴极上后析出的金属比先析出的金属金属性强。
B.元素非金属性强弱比较规律
I.依据元素周期表,同一周期中,从左到右,非金属性逐渐增强;同一主族中,由上到下,非金属性逐渐减弱。
II.依据最高价氧化物的水化物的酸性强弱,酸性越强,非金属性越强。
III.依据与H2化合的难易,越容易化合,非金属性越强。
IV.依据其气态氢化物的稳定性,稳定性越强,非金属性越强。
V.依据非金属单质与盐溶液之间的置换反应。
C.微粒半径大小比较规律
I.同周期阳离子半径随原子序数递增逐渐减小,如第3周期中:Na+>Mg2+>Al3+;同周期阴离子半径随原子序数递增逐渐减小,如第3周期中:P3->S2->Cl-。
II.同主族阳离子半径随原子序数递增逐渐增大,如第IA族中:Li<Na+<K+,同主族阴离子半径随原子序数递增逐渐增大,如第VIIA族中:F-<Cl-<Br-。
III.阳离子半径总比相应原子半径小,如Na+<Na,阴离子半径总比相应原子半径大,如S2->S。
IV.电子层结构相同的离子半径随原子序数的增大而减小,如S2->Cl->K+>Ca2+,O2->F->Na+>Mg2+>Al3+。
④元素的含量地壳中质量分数最大的元素是O,其次是Si;地壳中质量分数最大的金属元素是Al,其次是Fe;氢化物中氢元素质量分数最大的是C;所形成的有机化合物中种类最多的是C。
(3)解元素推断题的方法解答元素推断题,必须抓住原子结构和元素的有关性质,掌握元素周期表中主要规律,熟悉某些元素(短周期或前20号元素)的性质、存在和用途的特殊性,用分析推理法确定未知元素在周期表中的位置。对于有突破口的元素推断题,可利用题目暗示的突破口,联系其它条件,顺藤摸瓜,各个击破,推出结论。对无明显突破口的元素推断题,可利用题示条件的限定,逐渐缩小推求范围,并充分考虑各元素的相互关系予以推断。有时限制条件不足,则可进行讨论,得出合理结论,有时答案不止一组,只要能解释通都可以,若题目只要求一组,则选择自己最熟悉、最有把握的。有时需要运用直觉,大胆尝试、假设,再根据题给条件进行验证,也可推出。
正离子的离子结构示意图中核内质子数大于核外电子数;
负离子的离子结构示意图中核内质子数小于核外电子数。
原子是否满足最外层8电子结构的判断方法:
1.离子化合物
(1)阳离子:看“主族元素原子的次外层电子数+ 原子的最外层电子数一化合价数”是否等于8,若为8,则该原子满足最外层8电子结构,否则不满足。
(2)阴离子:看“其原子的最外层电子数+化合价的绝对值”是否等于8,若为8,则该原子满足最外层8 电子结构,否则不满足。
2.共价化合物计算“各原子的最外层电子数+化合价的绝对值” 是否等于8,若为8,则该原子满足最外层8电子结构,否则不满足。另外,还有一些不满足8电子结构的特殊粒子,请大家记住:
(1)主族元素形成的化合物中:
a.H、Li、Be、B元素原子不满足最外层8电子结构.
b.非最高价离子(如 Pb2+、Bi3+等)也不满足最外层8电子结构。
(2)过渡金属元素形成的离子最外层电子数一般大于8.
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
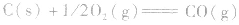 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。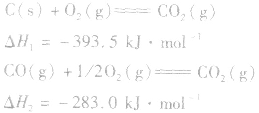
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
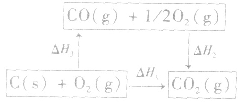
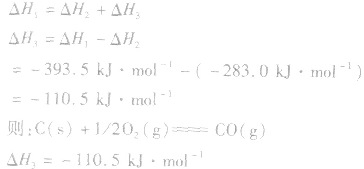
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
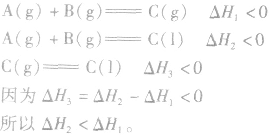
若按以下思路分析:
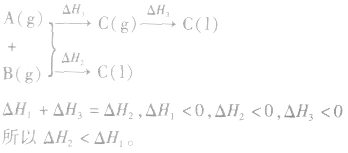
2.同一反应物状态不同时
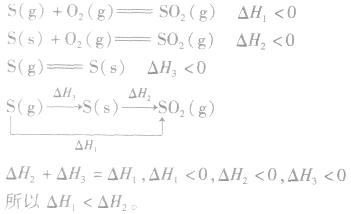
3.两个有联系的不同反应相比
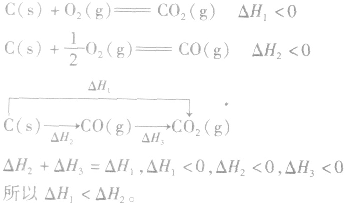
并且据此可写出下面的热化学方程式:

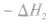
表示分子的结合或排列顺序的式子;如:
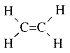
有机物分子中原子共直线、共平面问题的判断:
1、分子空间结构的基本类型:
2、分子中原子共线、共面情况的判断方法:
以上述分子结构为原型和思维起点,把复杂的有机物分子分解成几个部分,借助单键可以旋转、双键和三键不能旋转这一知识来分析所分解的各个部分,再予以综合,便能得出分子中在同一平面或同一直线上的原子数目。例如:分子中只要有碳原子形成4个单键,则所有原子小可能都在一个平面上, 中最多有6个原子(5个C原子、1个H原子)在同一条直线上,最多有15个原子(除一CH3上的2个氢原子外)在同一平面上。
中最多有6个原子(5个C原子、1个H原子)在同一条直线上,最多有15个原子(除一CH3上的2个氢原子外)在同一平面上。
与“X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,相关信息...”考查相似的试题有:
- 下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是[ ]A.B.C.D.
- X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是[ ]A.由mXa+与nYb-得m+a=n-bB.X2-的...
- A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:B元素原子的最外层电子数是内层电子数的2倍,C元素的最...
- 19世纪中叶,门捷列夫总结了如图所示的元素化学性质的变化情况。请回答(1)门捷列夫的突出贡献是[ ]A.提出了原子学说B.提出...
- 下列叙述正确的是( )A.沸点:CH4<SiH4<GeH4<SnH4B.离子半径:K+>Na+>S2->F-C.非金属性:F>O>P>SD.酸性:H2CO3...
- 与氢氧根具有相同质子数和电子数的微粒是[ ]A.F-B.Cl-C.NH3D.NH4+
- 下列说法错误的是( )A.在C(s)+H2O(g)CO(g)+H2(g)反应体系中,增加碳的量不能迅速提高正反应速率B.钾的金属性比钠...
- (6分)(2012•重庆)萤火虫发光原理如图:关于荧光素及氧化荧光素的叙述,正确的是( )A.互为同系物B.均可发生硝化反应C...
- 国家食品卫生标准规定,酱油中3-氯丙醇含量不超过。相对分子质量为94.5的氯丙醇(不含结构)共有A.2种B.3种C.4种D.5种
- 对羟基苯甲醛,俗称PHBA,是-种重要的有机化工原料。其结构如图所示。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:(1...