本试题 “下列说法正确的是( )A.O和O2-都是氧元素,所以它们的化学性质相同B.化学式为AB型的离子化合物中,阴阳离子所带电荷的数值必然相等C.m g食盐和n g水充分...” 主要考查您对溶液
物质的简单分类
离子化合物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶液
- 物质的简单分类
- 离子化合物
一种或几种物质分散到另一种物质中,形成均一、稳定的混合物,分散质粒子的直径d<10-9m
电中性原理:
溶液对外是不显电性的,所以,在电解质的溶液中,阳离子所带正电荷总数=阴离子所带负电荷总数。
如含K+、Al3+、H+、Cl-、SO42-的溶液中,必然存在c(K+)+3c(Al3+)+c(H+)=c(Cl-)+2c(SO42-)。
溶液的稀释定律:
- 稀释前后溶液中溶质的物质的量不变: c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
- 稀释前后溶液中溶质的质量不变: ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)
容量瓶的使用:
1.容量瓶的使用及注意事项
(1)在使用前首先要检查是否漏水。
具体操作如下:
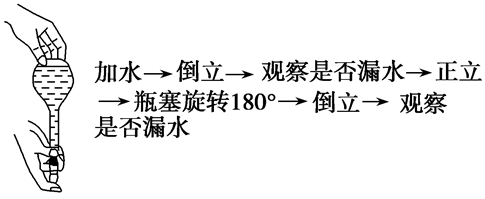
(2)检查合格后,用蒸馏水洗涤干净。
(3)四个“不能”
①不能将固体或浓溶液直接在容量瓶中溶解或稀释。
②不能作为反应容器或长期贮存溶液。
③容量瓶的容积是在瓶身所标温度下确定的,因而不能将过冷或过热的溶液转移到容量瓶中。
④只能配制容量瓶上规定容积的溶液,即不能配制任意体积的溶液。
2. 误差分析
分析依据 ,以配置NaOH溶液为例,在进行误差分析时,根据实验操作弄清是“m”还是“V”引起的误差,再具体分析,具体情况如下:
,以配置NaOH溶液为例,在进行误差分析时,根据实验操作弄清是“m”还是“V”引起的误差,再具体分析,具体情况如下:
| 能引起误差的一些操作 | 因变量 | c(mol/L) | |
| m | V | ||
| 砝码与物品颠倒(使用游码) | 减小 | —— | 偏低 |
| 称量时间过长 | 减小 | —— | |
| 用滤纸称NaOH | 减小 | —— | |
| 向容量瓶注液时少量溅出 | 减小 | —— | |
| 未洗涤烧杯和玻璃棒 | 减小 | —— | |
| 定容时,水多用滴管吸出 | 减小 | —— | |
| 定容摇匀后液面下降再加水 | —— | 增大 | |
| 定容时仰视刻度线 | —— | 增大 | |
| 砝码沾有其他物质或已生锈 | 增大 | —— | 偏高 |
| 未冷却至室温就注入容量瓶定容 | —— | 减小 | |
| 定容时俯视读数 | —— | 减小 | |
| 称量前小烧杯内有水 | —— | —— | 不变 |
| 定容后经振荡、摇匀,静置液面下降 | —— | —— | |
特别提醒:
(1)定容、摇匀后液面下降也不要补加蒸馏水,否则结果会偏低。
(2)定容时俯视、仰视对结果的影响。
①仰视刻度线(图1),导致溶液体积偏大。
②俯视刻度线(图2),导致溶液体积偏小。

为减小误差务必按:眼睛视线→刻度线→凹液面最低处的次序,做到“三点一线”。
一定物质的量浓度的溶液的配置:
1.主要仪器 (1)托盘天平:可精确至0.1g,称量前先调零,称量时物品放在左盘,砝码放在右盘。
(2)容量瓶:配制溶液的专用精确容器,瓶上标有温度、容积和刻度线。
(3)其他仪器:量筒、烧杯、玻璃棒、胶头滴管等。
2.配制过程
配制过程如下:

以配制480mL1mol·L-1NaCl溶液为例:
(1)所需容量瓶规格:500mL容量瓶。
(2)若用托盘天平应称量NaCl粉末29.3g。
(3)溶解过程中玻璃棒的作用为:搅拌加速溶解。
(4)移液
①移液前需要将溶液冷却至室温。
②移液中玻璃棒的作用为:引流。
③移液时需要进行的操作为:将烧杯中溶液注入容量瓶中,用少量蒸馏水洗涤烧杯内壁2~3次并将洗涤液也转入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀。
(5)定容
①当液面距瓶颈刻度线1~2cm时改用胶头滴管滴加蒸馏水。
②定容时要平视刻度线,直到凹液面最低点与刻度线相切。
(6)摇匀,转入试剂瓶保存
假如其他操作均准确无误,分析下列情况对配制浓度的影响。
①定容时俯视观察刻度线:偏高;
②移液时,对用于溶解NaCl的烧杯没有洗涤:偏低;
③定容后,将容量瓶振荡摇匀,静置后发现液面低于刻度线,又补水至刻度线:偏低。
溶液配制过程中的“四个数据”:
(1)选择容量瓶的规格时应该与所配溶液体积相等或稍大
数据
要求或解释
药品的质量
实验室中一般用托盘天平称量药品,而托盘天平只能称准0.1g,所以记录数据时只能保留小数点后一位数字。如题中NaOH的质量为10.0,不能写为10.00g
容量瓶的规格
(2)回答补充仪器的问题时应该注明容量瓶的规格,如应该回答“500ml容量瓶”,不能只回答“容量瓶”。
洗涤烧瓶2-3次
移液时洗涤烧瓶2-3次是为了确保溶质全部转移入容量瓶中,否则会导致溶液浓度偏低
液面离容量瓶颈刻度线下1-2cm
定容时,当液面离容量瓶颈刻度线下1-2cm时,应该改用胶头滴管滴加,否则溶液导致液体体积超过刻度线,导致溶液浓度偏低
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:

氧化物的分类:
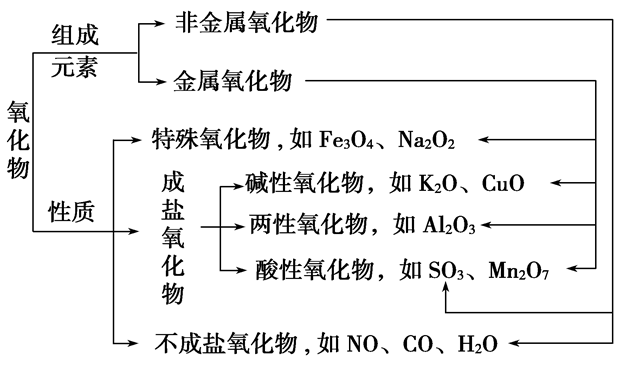
含有离子键的化合物称为离子化合物,离子化合物中肯定存在离子键,也可以存在共价键。
与“下列说法正确的是( )A.O和O2-都是氧元素,所以它们的化学...”考查相似的试题有:
- 下列有关胶体说法正确的是A.用过滤的方法可以分离出溶液与胶体B.在江河入海口处易形成沙洲C.一束平行光线照射蛋白质溶液时...
- 物质的分类有多种方法,从下列选项可知HNO3应属于( )①酸; ②氧化物; ③含氧酸; ④难挥发性酸; ⑤一元酸; ⑥化合物.A.①②③④...
- 下列物质属于纯净物的是( )A.水煤气B.天然气C.纯碱D.石灰乳
- 分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是①根据酸分子中含有的氢原子个数将酸分为一元酸、二元...
- 化学变化不能实现的是 ( )①一种原子变成另一种原子②一种离子变成另一种离子③一种分子变成另一种分子④一种单质变成另一种单质⑤...
- 下列物质分类正确的是( )ABCD酸HCl气体硫酸醋酸盐酸碱熟石灰烧碱纯碱NH3•H2O盐小苏打胆矾碱式碳酸铜NaHSO4氧化物水过氧化氢...
- 下列说法正确的是[ ]A. 磷酸、碱石灰、绿矾分别属于酸、碱、盐B. 医院里做的“血清纸上电泳”是利用了血清里胶体的粒子大小在1-...
- 下列叙述中,正确的是A.纯碱、烧碱均属于碱B.凡能电离出H+的化合物均属于酸C.CuSO4·5H2O属于纯净物D.盐类物质一定含有金...
- 已知0.1 mol/L的NaHSO4溶液中H+的浓度为0.1 mol/L,请回答下列问题:(1)写出NaHSO4在水溶液中的电离方程式:________________...
- 下列每组中各物质内既有离子键又有共价键的一组是( ) A.NaOH、H2SO4、(NH4)2SO4 B.Mg(OH)2、Na2SO4、NH4HCO3 C.Na2O...