本试题 “在化学反应3H2+Fe2O32Fe+3H2O中,反应物中各物质间的质量比为[ ]A.1:1B.3:1:2:3C.3:80:56:27D.1:80:28:9” 主要考查您对化学反应方程式的意义
相对分子质量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式的意义
- 相对分子质量
化学方程式的概念:
用化学式来表示化学反应的式子。如C+O2 CO2是碳充分燃烧的化学方程式。
CO2是碳充分燃烧的化学方程式。
化学方程式的意义、读法:
(1)化学方程式的意义
化学方程式还能表示化学反应的类型。如化学方程式Zn+H2SO4==ZnSO4+H2↑是一个置换反应。
(2)化学方程式的三种读法
化学方程式中“+”和“=”虽与数学中的“+”和 “=”形式一样,但其意义却不相同。化学方程式中的 “+”,读时不读“加”而是读“和”或“与”;化学方程式中的“=”也不同于数学意义上的“=”,它表示“生成” 的意思,同时表明在化学反应前后有两个不变:原子种类不变,每种原子的总个数也不变,“=”读作“反应生成”,而不能读作“等于”。 一个化学方程式往往有三种读法,现以2H2O 2H2↑+O2↑为例加以说明。
2H2↑+O2↑为例加以说明。
①质的方面:在通电的条件下,水分解生成氢气和氧气。这种读法说明了化学反应中物质的变化,能表示出反应物、生成物、反应条件。
②粒子方面:在通电的条件下,每2个水分子分解生成2个氢分子和1个氧分子。这种读法揭示了化学反应中物质拉子结构的变化,并反映出粒子个数的比例关系。
③量的方面:在通电的条件下,36份质量的水分解生成4份质量的氢气和32份质量的氧气。这种读法表明了化学反应前后物质的质量守恒关系。
用化学式来表示化学反应的式子。如C+O2
 CO2是碳充分燃烧的化学方程式。
CO2是碳充分燃烧的化学方程式。 化学方程式的意义、读法:
(1)化学方程式的意义
| 意义 | 实例C+O2 CO2 CO2 |
| (质的方面)表示反应物、生成物和反应条件 | |
| (量的方面) ①表示反应物、生成物之间的质量比各物质间 质量比=相对分子质最与化学计量数的乘积比 ②表示反应物、生成物之间的微粒个数比,即 化学式前的化学计量数之比 |
C+O2 CO2 CO2(12×1):(32×1):(41×1) C+O2  CO2 CO21:1:1 |
(2)化学方程式的三种读法
化学方程式中“+”和“=”虽与数学中的“+”和 “=”形式一样,但其意义却不相同。化学方程式中的 “+”,读时不读“加”而是读“和”或“与”;化学方程式中的“=”也不同于数学意义上的“=”,它表示“生成” 的意思,同时表明在化学反应前后有两个不变:原子种类不变,每种原子的总个数也不变,“=”读作“反应生成”,而不能读作“等于”。 一个化学方程式往往有三种读法,现以2H2O
 2H2↑+O2↑为例加以说明。
2H2↑+O2↑为例加以说明。 ①质的方面:在通电的条件下,水分解生成氢气和氧气。这种读法说明了化学反应中物质的变化,能表示出反应物、生成物、反应条件。
②粒子方面:在通电的条件下,每2个水分子分解生成2个氢分子和1个氧分子。这种读法揭示了化学反应中物质拉子结构的变化,并反映出粒子个数的比例关系。
③量的方面:在通电的条件下,36份质量的水分解生成4份质量的氢气和32份质量的氧气。这种读法表明了化学反应前后物质的质量守恒关系。
定义:
相对分子质量就是化学式中各原子的相对原子质量的总和,符号为Mr。如化学式为AmBn的物质的相对分子质量Mr=A的相对原子质量×m+B的相对原子质量×n。
易错易混点:
①化学式中原子团右下角的数字表示其个数(但BaSO4中的4表示氧原子的个数.不表示原子团 SO42-的个数),计算时先求一个原子团的相对质量,再乘以其个数。如Ca(OH)2的相对分子质量=40+(1+16)× 2=74;
②化学式中的圆点,如“CuSO4·5H2O”中的“·” 表示和,不表示积。即CuSO4·5H2O的相对分子质量CuSO4的相对分子质量+H2O的相对分子量×5=160+18×5=250;
③相对分子质量的单位为1,书写时省略不写;
④计算多个相同分子的相对分子质量总和时,应先求出化学式的相对分子质量再乘以前面的系数,如2KClO,的相对分子质量=2×(39+35.5+16×3) =245;
⑤若已知化合物中某原子的相对原子质量A和原了个数n及其质量分数x%,则化合物的相对分子质量=
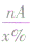
发现相似题
与“在化学反应3H2+Fe2O32Fe+3H2O中,反应物中各物质间的质量比为...”考查相似的试题有:
- 下图是元素周期表中某元素的相关信息,从图中不能直接获得的信息是( )A.该元素属于非金属元素B.该元素的原子序数为7C.该...
- 下列符号中,对”2” 含义的理解正确的是( )a、2Cl b、2SO3 c、P2O5 d、Ca2+e、A.表示2个分子的是 a和bB.表示1个离子中带有2...
- 下列化学用语表达正确的是A.1个氮分子——N2B.2个氧原子——O2C.3个钠离子——3D.硝酸铁——Fe(NO)3
- +6价硫元素的氧化物的化学式为A.SO2B.SO3C.Na2SO4D.H2SO4
- 用数字和符号表示:(1)2个银原子 ;(2)3个亚铁离子 ;(3)2个氢氧根离子 ;(4)三氧化硫中硫元素显+6价 。
- 下列应用和相应的原理(用化学方程式表示)及基本反应类型均正确的是( )A.用过氧化氢溶液制氧气 2H2O22H2O+O2↑分解反应B....
- 下列关于耐高温新型陶瓷材料氮化硅(Si3N4)的叙述正确的是A.氮化硅中氮元素的质量分数为40%B.氮化硅是有机高分子合成材料C...
- 与元素化学性质关系最密切的是A.质子数B.中子数C.最外层电子数D.电子数
- 请根据下图某厂家生产的发酵粉包装上标签的信息计算:(1)NaHCO3的相对分子质量;(2)一包该发酵粉含NaHCO3多少g?(3)一...
- 2004年~2005年,自肯德基新奥尔良烤翅和新奥尔良烤鸡腿堡调料中被发现含有“苏丹红一号”,国内所有肯德基餐厅已停止出售这两...