本试题 “实验室开放日,某化学兴趣小组的同学在老师的指导下,进行了“自选仪器设计实验”的活动.实验室准备的仪器如下图所示:(1)小凡同学一眼就认出仪器B是______...” 主要考查您对常用仪器的名称和选用
过滤
氧气的制取和收集
溶液的配制
化学实验数据的分析
化学反应方程式的书写
文字表达式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 常用仪器的名称和选用
- 过滤
- 氧气的制取和收集
- 溶液的配制
- 化学实验数据的分析
- 化学反应方程式的书写
- 文字表达式
试管、烧杯、蒸发皿、坩埚、酒精灯、漏斗、洗气瓶、干燥管、
托盘天平、量筒、容量瓶、滴定管、玻璃棒、量气装置等。
常用仪器对比分析:
|
常见的化学仪器 |
主要用途 | ||
|
分类 |
名称 |
图示 | |
| 用于加热仪器 | 试管 |  |
(1)用作少量试剂的反应容器,在常温或加热时使用 (2)作为小型气体发生器 (3)收集少量气体 |
| 蒸发皿 |  |
用于溶液的蒸发、浓缩 | |
| 燃烧匙 |  |
用于盛放可燃性固体物质进行燃烧实验 | |
| 烧杯 |  |
(1)溶解物质配制溶液 (2)较大量试剂反应容器 (3)常温或加热使用 | |
| 锥形瓶,烧瓶(圆底,平底) | 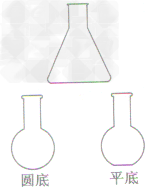 |
(1)用作较大量液体反应的容器和气体发生装置,在常温或加热时使用 (2)锥形瓶是蒸馏的接收容器 | |
| 酒精灯 | 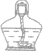 |
用于加热 | |
| 盛放物质的仪器 | 集气瓶 |  |
(1)收集和储存少量气体 (2)进行物质和气体之间的反应 |
| 滴瓶,滴管 | 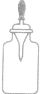 |
滴瓶用于盛放少量液体试剂 | |
| 细口瓶 | 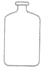 |
储存液体药品 | |
| 广口瓶 |  |
储存固体药品 | |
| 计量仪器 | 托盘天平 | 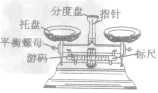 |
称量物质的质量(精确度为0.1g) |
| 量筒 |  |
量取一定体积的液体或间接测量气体的体积 | |
| 漏斗 | 普通漏斗 |  |
过滤,注入液体 |
| 长颈漏斗 |  |
用于注入液体 | |
| 分液漏斗 |  |
(1)注入液体 (2)分液漏斗用于分离两种密度不同且互不相溶的液体 | |
| 夹持仪器 | 铁架台 |  |
固定和放置各种仪器 |
| 试管夹 |  |
夹持试管进行简单的加热试验 | |
| 坩埚钳 |  |
夹持坩埚或夹持热的蒸发皿等 | |
| 辅助仪器 | 水槽 |  |
排水集气 |
| 药匙 |  |
取用固体药品(粉末状或小颗粒状) | |
| 玻璃棒 |  |
搅拌液体,引流,沾取液体 | |
| 石棉网 |  |
用于烧杯或烧瓶加热时垫在底部,使仪器受热均匀 | |
| 试管刷 |  |
用于刷洗试管等玻璃仪器 | |
| 温度计 |  |
用于测量温度 | |
过滤定义:
利用介质滤除水中杂质的方法。
通过特殊装置将流体提纯净化的过程,过滤的方式很多,使用的物系也很广泛,固-液、固-气、大颗粒、小颗粒都很常见。
在推动力或者其他外力作用下悬浮液(或含固体颗粒发热气体)中的液体(或气体)透过介质,固体颗粒及其他物质被过滤介质截留,从而使固体及其他物质与液体(或气体)分离的操作。
过滤归纳:
| 过滤的原理 | 其中一种能溶于水,另一种不能溶于水,则可以先把它们充分溶于水中,再进行过滤分离 |
| 制作过滤器 | 把一张圆形滤纸连续对折两次,得到一个四层的扇形滤纸,然后再用手捏住最外面一层滤纸展开,便得到一个一边是一层,另一边是三层的滤纸,用少量水润湿一下,把它贴在漏斗内壁上即可。 |
| 用到的仪器 | 铁架台(带铁圈)、烧杯、漏斗、玻璃棒、滤纸等 |
| 过滤装置 | 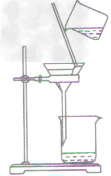 |
| 注意事项 | 操作注意事项有:一贴、二低、三靠。 一贴:滤纸紧贴漏斗内壁,以没有气泡为准,可加快过滤的速度; 二低:滤纸边缘低于漏斗边缘;漏斗内液面低于滤纸边缘,防止液体从滤纸与漏斗之间的间隙流下,使过滤不充分; 三靠:盛待过滤液体的烧杯紧靠引流的玻璃棒,防止液体溅到漏斗外丽;玻璃棒的下端紧靠在三层滤纸上,防止戳破滤纸;漏斗下端长的那侧管口紧靠烧杯内壁,防止液体溅出 |
| 过滤失败的原因 | ①滤纸破损;②过滤时液面高于滤纸边缘; ③收集滤液的烧杯不洁净 |
| 过滤操作实验口诀 | 斗架烧杯玻璃棒,滤纸漏斗角一样。 过滤之前要静置,三靠两低不要忘。 |
氧气的制取是初中化学的重点,也是历年中考的热点。我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。中考对制取氧气的考查主要集中在药品选用、实验装置、操作步骤等方面。
实验室制取收集氧气:
| 过氧化氢制氧气 | 高锰酸钾制氧气 | |
| 药品和反应原理 | 2H2O2 2H2O+O2↑ 2H2O+O2↑ |
2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| 发生装置 | 固液常温型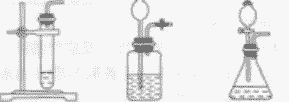 |
固体加热型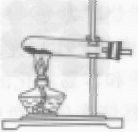 |
| 收集装置 | 氧气可用排水法收集,也可用向上排空气法收集 | |
| 整体装置图 | 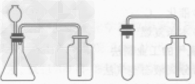 |
 |
| 操作步骤 | ①检查装置气密性 ②再锥形瓶中装入二氧化锰 ③塞好带有长颈漏斗和导管的橡皮塞(长颈漏斗的下端一定在液面以下,否则氧气会从长颈漏斗中跑出来) ④向长颈漏斗中加入过氧化氢溶液 ⑤收集氧气 |
①检查装置气密性 ②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花) ③将试管固定在铁架台上 ④点燃酒精灯,预热后加热试管 ⑤当导管口有连续均匀的气泡冒出时开始收集气体 ⑥收集完毕,先将导管移出水面 ⑦熄灭酒精灯。加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。可用谐音记忆为“茶庄定点收利息”。 |
| 注意事项 | ①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。 ②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。 ③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。 ④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。 |
①药品要平铺在试管底部,均匀受热。 ②试管口要略向下倾斜,防止药品中湿存的水分受热后变成水蒸气,遇冷凝结成水倒流回试管底部,使试管炸裂。 ③铁架台的铁夹要夹在试管的中上部(或距离试管口1/3处)。 ④试管内的导管稍伸出橡皮塞即可,这样便于气体导出。 ⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。 ⑥加热时要先使试管均匀受热,然后酒精灯外焰要对准药品所在部位加热。 ⑦用排水法收集气体时,应注意当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有大盆气泡冒出时,证明已集满。 ⑧停止加热时,应先把导管从水里撤出,再撤掉酒精灯。如果先熄灭酒精灯,试管内气体温度降低,压强减小,水槽中的水就会被倒吸入热的试管内,使试管炸裂。 ⑨用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾小颗粒进人导管。 ⑩盛氧气的集气瓶应盖上玻璃片正放,因为在相同状况下氧气的密度大于空气的密度,正放可减少气体的逸散。 |
知识梳理:
1 、固体 + 水
①实验步骤:计算—称量—量取—溶解
②实验器材:托盘天平 + 药匙(或镊子) ;合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、称量和量取都要准确,溶解时固体要溶解完全
2 、液体 + 水
①实验步骤:计算—量取—溶解
②实验器材:合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、量取都要准确,同时需要两种不同规格的量筒
配制溶液的步骤:
(1)用溶质和水配制一定溶质质量分数的溶液
①实验用品:托盘天平、烧杯、量筒、胶头滴管、玻璃棒、药匙等。
②实验步骤:
计算→称量药品→量取水→搅拌溶解
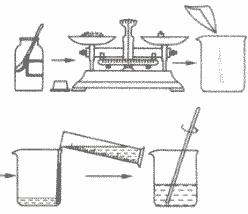
a.计算所需溶质和水的质量;
b.用托盘天平称量所需溶质,倒入烧杯中;
c.把水的密度近似看作1g/cm3,用量筒量取一定体积的水,倒入盛有溶质的烧杯里,用玻璃棒搅拌,使溶质溶解;
d.把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中。
③导致溶液质量分数变化的因素
a.称量时物质和砝码的位置放错,如止确称量5.8gNaCl,应在右盘放置5g砝码,再用0.8g游码,若放错位置,将砝码放在天平的左盘,则实际称量NaCl的质量为5g-0.8g=4.2g,这样会导致配制的溶液溶质质量分数变小;
b.量筒量取水的体积时读取示数错误,读取示数时仰视读数所量取水的实际体积大于理论值,将会使配制的溶液溶质质量分数变小;读取示数时俯视读数所量取水的实际体积小于理论值,将会使配制的溶液溶质质量分数变大;
c.将量筒中的水倒入烧杯时洒落到外面或未倒净,将导致溶液溶质质最分数偏大;
d.所用固体不纯,将会导致溶液溶质质量分数偏小;
e.计算错误可能会导致溶液溶质质量分数偏大或偏小。
配制溶液时导致溶质质量分数变化的原因:
在配制一定质量和一定质量分数的溶液过程中,经常会出现所得溶液溶质质量分数偏大或偏小的情况。
1. 所配溶液溶质质量分数偏小的原因:
①从计算错误角度考虑:水的质量算多了,溶质的质量算少了;
②从用托盘大平称量的角度考虑:天平读数有问题。药品和砝码放颠倒了,左盘放纸片但右盘没有放纸片,调零时,游码未拨回“0”刻度等;
③从用量筒量取液体的角度考虑:量取溶剂时,仰视读数了;
④从转移药品角度考虑:烧杯不干燥或烧杯内有水,量筒中的液体溶质未全部倒人烧杯中;
⑤从药品的纯度角度考虑:溶质中含有杂质
2. 所配溶液溶质质量分数偏大的原因
①称量时,所用砝码已生锈或沾有油污;②量取溶剂时,俯视读数了。
综合配制溶液的计算利用:
所提供的信息可选取多种方案配制所需的溶液。如现有KCl固体、蒸馏水、5%的KCl溶液、15%的KCl溶液,配制100g10%的KCl溶液,其方案有:
| 所需药品 | 主要步骤 | |
| 一 | 10gKCl+90g蒸馏水 | 用天平称量10gKCl,用量筒量取90ml水,分别倒入烧杯,用玻璃棒搅拌至KCl固体全部消失 |
| 二 | 66.7g15%的KCl溶液33.3g蒸馏水 | 用量筒量取33.3mL水,用天平称66.7g15%的KCl溶液,混合均匀即可 |
| 三 | 5.3gKCl+94.7g 5%的KCl溶液 | 用天平称量5.3gKCl固体和94.7g 5%的KCl溶液,将5.3gKCl倒入94.7g5%的KCl溶液中,用玻璃棒搅拌至KCl固体全部消失 |
| 四 | 50g5%KCl溶液+50g15%KCl 溶液 | 用天平称量5%、15%的KCl溶液各50g,混合均匀即可 |
常见的易混易错的数据:
1. 托盘天平称量的质量只能精确到小数点后1位。
2. 量筒测量溶液的体积,精确到小数点后1位。
3. 温度计测量的温度数据精确到小数点后1位。
4. pH试纸测量溶液的pH值只能精确到整数位。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
与“实验室开放日,某化学兴趣小组的同学在老师的指导下,进行了“...”考查相似的试题有:
- 下图是实验室制取CO2和验证CO2性质的装置:(1)写出图中标号为a的仪器名称:__________;(2)A装置中发生反应的化学方程式...
- 今年我市化学实验操作测试有五条考题:即①化学变化的现象 ②氧气的制取、收集和验满 ③粗盐提纯 ④碱的性质 ⑤一定溶质质量分数的...
- 对比H2和CO还原氧化铜的实验,错误的说法是 A.通气体前,都应先检验气体纯度B.加热前,都应排尽装置内的空气C.两个实验都...
- 随着社会的发展,人类对水资源造成了污染,很多天然水都不能直接使用。M是一种新型的自来水消毒剂,工业上制取M的化学方程式...
- 硫元素的化合价为+4价的物质是A.H2SB.SC.SO2D.H2SO4
- 按要求完成下列反应的化学方程式:(1)乙醇在氧气中燃烧__________________。(2)加热高锰酸钾制氧气_________________。
- 钢铁、铝合金、铜制品等是应用广泛的金属材料。据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一。某校化...
- 除去下列括号内的杂质(用化学方程式表示)(1)CO2(CO)______;(2)HCl(H2SO4)______;(3)NaCl(NH4HCO3)______.
- 根据下列实验装置图,回答问题:(1)写出标有序号的仪器的名称①_________、②_________.用B、C组合,可以制取一种气体,其反...
- 氧气、氢气、二氧化碳是初中常见的气体,根据如图中装置及仪器回答问题:(1)写出仪器a、b的名称:a、______b、______.(2...