本试题 “下列有关实验原理、装置、操作或结论的描述中,不正确的是(有关装置中的夹持仪器略去未画)[ ]A.制备少量氧气B.制取SO2、检验SO2的漂白性C.分离Cl2与KI溶...” 主要考查您对物质的分离
氯气的制取
乙烯的制取
二氧化硫的制取
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的分离
- 氯气的制取
- 乙烯的制取
- 二氧化硫的制取
分离与提纯的原则和要求:
(1)选择分离与提纯方法应遵循的原则
①不增:指不能引入新的杂质。
②不减:指应尽可能减少被分离与提纯的物质的损失。
③易分离:指如果使用试剂除去杂质时,要求反应后的产物跟被提纯的物质容易分离。
④易复原:指分离物或被提纯的物质都要容易复原。
(2)分离与提纯操作过程应遵循“三必须”
①除杂质试剂必须过量;
②过量试剂必须除尽(因过量试剂会带人新的杂质);
③除杂途径必须选最佳。
常见的分离与提纯的方法:
(1)物质分离与提纯常用的物理方法
| 方法 | 适用范围或原理 | 装置 | 举例 | 注意事项 |
| 过滤 | 分离固体和液体混合物 | 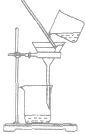 |
粗盐提纯时把粗盐溶于水,经过滤把不溶于水的杂质除去 | ①要“一贴二低三靠” 滤纸紧贴漏斗内壁;滤纸边缘低于漏斗口,漏斗里液面低于滤纸边缘;烧杯口紧靠玻璃棒,玻璃捧下端紧靠三层滤纸.漏斗下端紧靠烧杯内壁。 ②必要时洗涤沉淀物(在过滤器中加少量水),不可搅拌 |
| 结晶 重结晶 |
分离各组分在溶剂中的溶解度随温度变化不同的混合物 | 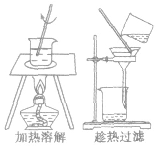 |
KNO3溶解度随温度变化大, NaCl溶解度随温度变化小,可用该法从二者的混合液中提纯KNO3 | ①一般先配较高温度下的浓溶液,然后降温结晶 ②结晶后过滤,分离出晶体 |
| 蒸发 | 溶解度随温度变化较小的物质 |  |
从食盐水溶液中提取食盐晶体 | ①溶质应不易分解、不易水解、不易被氧气氧化 ②蒸发过程应不断搅拌 ③近干时停止加热,余热蒸干 |
| 蒸馏 | 分离沸点不同的液体混合物 | 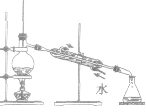 |
制无水乙醇(加生石灰)、硝酸的浓缩[加浓硫酸或 Mg(NO3)2] | ①温度计水银球在蒸馏烧瓶支管口处 ②加沸石(碎瓷片) ③注意冷凝管水流方向应下进上出 ④不可蒸干 |
| 分馏 | 分离多种液态混合物 | 同蒸馏 | 石油分馏 | 同蒸馏 |
| 萃取 | 分离两种互溶的液体 |  |
CCl4把溴水中的Br2萃取出来 |
①萃取后再进行分液操作 ②对萃取剂的要求:与原溶剂互不混溶,不反应;溶质在其中的溶解度比在原溶剂中大;溶质不与萃取剂反应 ③萃取后得到的仍是溶液,一般要通过分馏等方法进一步分离 |
| 分液 | 分离两种不相混溶的液体(密度不同) | 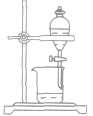 |
水、苯的分离 | 下层液体从下口放出,上层液体从上口倒出 |
| 液化 | 利用气体混合物中某组分易液化的特点来分离 | 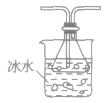 |
除去SO2中的SO3 | 可把锥形瓶换成硬质大试管 |
| 盐析 | 利用某些物质在加某些无机盐时,其溶解度降低而凝聚的性质来分离物质 | —— | 从皂化液中分离肥皂、甘油,蛋白质的盐析 | 盐析是物理变化。盐析之后一般要采取过滤的操作 |
| 洗气 | 杂质气体易溶于某液体 | 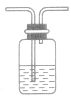 |
除去CO2中的HCl气体,可使混合气体通过盛有饱和NaHCO3 溶液的洗气瓶 | ①从洗气瓶的长导管一端进气 ②混合物中气体溶解度差别较大 |
| 升华 | 利用某些物质有升华的特性 |  |
粗碘中碘与钾、钠、钙、镁的碘化物混合,利用碘易升华的特点将碘与杂质分开 | 升华物质的集取方法不作要求 |
| 渗析 | 胶体提纯、精制 | 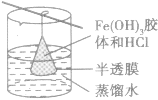 |
除去Fe(OH)3胶体中的HCl | 要不断更换烧杯中的水或改用流动水,以提高渗析效果 |
(2)物质分离与提纯常用的化学方法:
①加热法
混合物中混有某些热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出来。例如:食盐中混有氯化铵、纯碱中混有小苏打等均可直接加热除去杂质。
②沉淀法
在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该方法一定要注意不能引入新杂质,若使用多种试剂将溶液中不同粒子逐步沉淀时,应注意后加入试剂能将先加入的过量试剂除去,最后加入的试剂不引入新杂质。例如:加入适量BaCl2溶液可除去NaCl中混有的Na2SO4。
③转化法
利用化学反应将某种物质进行多次转化而分离。例如:分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3和NaAlO2,过滤后,分别再加盐酸重新生成Fe3+和Al3+。注意转化过程中尽量减少被分离物质的损失.而且转化后的物质要易恢复为原物质。
④酸碱法
被提纯物质不与酸或碱反应,而杂质可与酸或碱发生反应,可用酸或碱作除杂试剂。例如:用盐酸除去 SiO2中的石灰石,用氢氧化钠除去铁粉中的铝粉。
⑤氧化还原法
a.对混合物中混有的还原性杂质,可加入适当的氧化剂将杂质氧化为被提纯物质。例如:将氯水滴入混有FeCl2的FeCl3溶液中,除去FeCl2杂质。
b.对混合物中混有的氧化性杂质,可加入适当还原剂将杂质还原为被提纯物质。例如:将过量铁粉加入混有FeCl3的FeCl2溶液中,振荡过滤,除去FeCl3 杂质。
⑥调节pH法
通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法。一般加入相应的难溶或微溶物来调节。例如:在CaCl2溶液中含有FeCl3杂质,由于 Fe3+水解,溶液呈酸性,可采用调节溶液pH的方法将 Fe3+沉淀除去,为此,可向溶液中加氧化钙或氢氧化钙或碳酸钙等。
⑦电解法
此法利用电解原理来分离、提纯物质。例如:电解精炼铜,将粗铜作阳极,精铜作阴极,电解液为含铜离子的溶液,通直流电,在阳极铜及比铜活泼的杂质金属失电子,在阴极只有铜离子得电子析出,从而提纯了铜。
氯气的实验室制法:
(1)实验室用浓盐酸和二氧化锰反应制取氯气。 
(2)装置图: 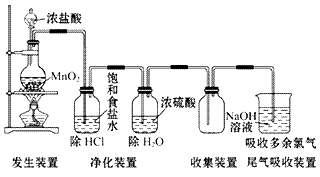
(3) 步骤: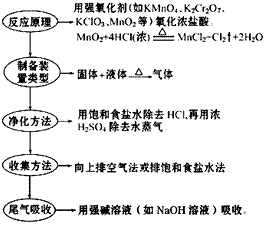

氯气的工业制法:
(1)电解饱和食盐水(氯碱工业),化学方程式为: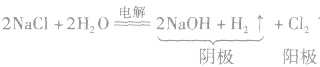
(2)电解熔融的氯化钠(可制得金属蚋),化学方程式为:
(3)电解熔融的氯化镁(可制得金属镁),化学方程式为:
乙烯的制取:
(1)实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液--液加热型
C2H6O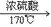 CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)装置图: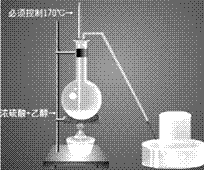
(3) 注意事项:
①酒精和浓硫酸按体积1比3混和,使乙醇利用率提高,必须使用无水酒精,而且必须控制170摄氏度才能制得乙烯。装置连接时由下至上,由左至右。温度计插入液面下。
②烧瓶内加沸石以避免暴沸。
③温度计水银头插入液面下,但不要接触烧瓶底部,以测定液体温度。
④要使液面温度迅速升到170摄氏度,以避免副反应发生。
(4)收集方法:乙烯的密度与空气相当,所以不能用排空气取气法,只能用排水法收集。
检验:点燃时火焰明亮,冒黑烟,产物为水和CO2;通入酸性高锰酸钾溶液中,紫色高锰酸钾褪色。
(5)实验现象:生成无色气体,烧瓶内液体颜色逐渐加深。
(6)两点说明
①实验室中用无水乙醇和浓硫酸制取乙烯气体,加热不久圆底烧瓶内的液体容易变黑,原因是:浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色。制得的C2H4中往往混有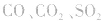 等气体。
等气体。
②实验时要求使反应温度迅速卜升到170℃并稳定在170℃左右,因该温度下主要产物是乙烯和水,而在140℃时主要产物是乙醚和水,当温度高于170℃ 时,乙醇和浓硫酸发生的氧化反应更加突出,反应产物有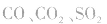 等多种物质。相关反应方程式为:
等多种物质。相关反应方程式为: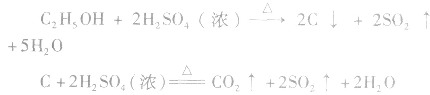
1、制取原理:
稳定性强酸与不稳定性弱酸盐的复分解
2、制取方程式
Na2SO3+H2SO4(浓)
 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O 3、制取装置
分液漏斗,圆底烧瓶
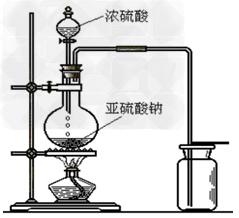
4、检验
先通入品红试液,褪色,后加热又恢复原红色
5、除杂质
通入浓H2SO4(除水蒸气)
6、收集
向上排气法
7、尾气回收
SO2+2NaOH===Na2SO3+H2O
与“下列有关实验原理、装置、操作或结论的描述中,不正确的是(...”考查相似的试题有:
- 下列说法正确的是A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液B.氨基酸是人体必需的营养物质,其...
- 在溴水中加入汽油,充分振荡后,上层溶液的颜色为 ,原因是 。要把这两层液体分开,用到的玻璃仪器是 ,进行的实验操作是 。
- 下列四组实验,根据实验事实得出的结论,正确的是A.在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀盐酸不溶解——原未...
- 用括号内的试剂和分离方法,除去下列物质中的少量杂质,正确的是A.乙醇中的乙酸(碱石灰,蒸馏)B.乙烷中的乙烯(NaOH溶液...
- 下列说法错误的是A.定性实验可以确定物质的元素组成,也可以确定有机物所含官能团B.定量实验可以确定有机物的最简式,也可...
- 除去下列物质中所含的少量杂质,下表中除杂方法正确的是选项物 质所含杂质除杂质的方法A氧化铜氯化钠加水溶解、过滤、蒸发结...
- 为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是 被提纯的物质除杂试剂分离方法A乙酸乙酯(乙...
- 欲从苯酚的乙醇溶液中分离苯酚和乙醇,有下列操作:①蒸馏 ②过滤 ③静置分液 ④加入足量的金属钠 ⑤通入过量的二氧化碳 ⑥加入足量...
- 分离或提纯下列物质,应选用下述哪一种?(填序号)A、分液 B、过滤 C、萃取 D、蒸馏 E、结晶 F、加热分解 H、渗析(1)除去C...
- 下列气体中,不能用排空气收集的是 ( )A.NOB.NH3C.CO2D.H2