本试题 “下列有关说法正确的是( )A.铁制品镀层受损后,镀铜铁比镀锌铁更容易生锈B.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0C.N2(g...” 主要考查您对单质铝
焓变、反应热
影响化学反应速率的因素
金属的电化学腐蚀
金属的化学腐蚀
金属的电化学防护
金属的表面防护
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铝
- 焓变、反应热
- 影响化学反应速率的因素
- 金属的电化学腐蚀
- 金属的化学腐蚀
- 金属的电化学防护
- 金属的表面防护
铝的主要性质:
- 物理性质:
铝是银白色,具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。 - 化学性质:
活泼金属,具有较强的还原性;常温下铝在浓硫酸和浓硝酸中发生钝化;既可以与酸反应又可以与碱反应。
(1)与氧气反应: (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光)
(2)与Cl2 、S 、N2反应: (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)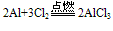
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑)
(3)与水反应: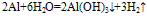
(4)与酸反应: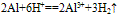
(5)与碱的反应:
(6)铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe - 铝的用途
纯铝制作导线,铝合金用于制造飞机、汽车、生活用品等。
铝的特殊性质:
铝既能与酸反应,也能与强碱反应。
铝与酸反应:铝与浓硫酸在常温下发生钝化,2Al+6HCl==2AlCl3+3H2↑
铝与碱反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑
铝热反应:
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。此种反应被称为铝热反应。
可简单认为是铝与某些金属氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)或非金属氧化物(如SiO2等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应,
其中镁条为引燃剂,氯酸钾为助燃剂。
其装置如下图所示: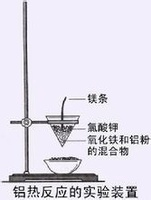
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,然后便可得到Al为8,Fe为9。
镁铝的化学性质比较:
| 单质 | 镁 | 铝 |
| 与非金属反应 | 2Mg+O2=(点燃)=2MgO (发出耀眼白光) Mg+Cl2=(点燃)=MgCl2 3Mg+N2=(点燃)=Mg3N2 |
4Al+3O2=(加热)=2Al2O3 2Al+3Cl2=(加热)=2AlCl3 2Al+3S=(加热)=Al2S3 |
| 与沸水反应 | Mg+2H2O=(加热)=Mg(OH)2+H2↑ | 不反应 |
| 与酸反应 | Mg+2H+==Mg2++H2↑ 与稀硝酸反应生成Mg(NO3)2、NOx(或者N2、NH4NO3)、H2O |
2Al+6H+==2Al3++3H2↑ 在冷的浓硝酸或浓硫酸中钝化 |
| 与氧化物反应 | 2Mg+CO2=(点燃)=2MgO+C (剧烈燃烧,生成白色粉末和黑色固体) |
2Al+Fe2O3=(高温)=2Fe+Al2O3(铝热反应) |
| 与盐溶液反应 | Mg+2NH4++2H2O==Mg2++2NH3·H2O+H2↑ Mg+Cu2+==Mg2++Cu |
2Al+3Hg2+=2Al3++3Hg |
| 与强碱反应 | 不反应 | 2Al+2OH-+2H2O==2AlO2-+3H2↑ |
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下便可得到Al为8,Fe为9。
铝与酸、碱反应的计算技巧:
铝与酸、碱反应的实质都是 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: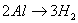 ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。
铝与酸或碱溶液反应生成H2的量的计算:
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1molAl不论与H+还是与OH-反应均生成3gH2。
不同点:1molAl与H+反应消耗3molH+,而与OH-反应只消耗1molOH-,所以含有等物质的量的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。

“铝三角”关系:
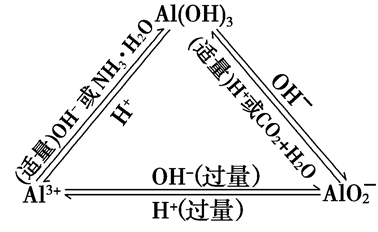
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
钝化:
铝、铁在常温下与浓硫酸发生钝化,钝化不是不反应,而是被氧化成一层致密的氧化物薄膜,恰恰说明金属的活泼性。
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
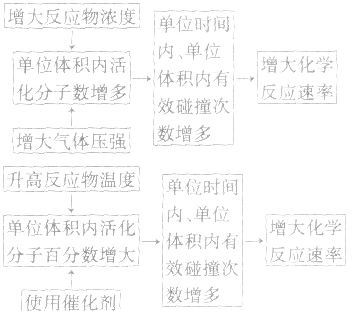
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
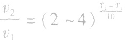
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
金属的腐蚀:
1.金属腐蚀的概念金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.金属腐蚀的实质金属原子(M)失去电子而被氧化的过程。
M-ne-==M n+
金属的电化学腐蚀:
不纯的金属或合金因发生原电池反应而造成的腐蚀。最普遍的钢铁腐蚀是:
负极:2Fe-4e-=2Fe2+
正极:O2+2H2O+4e-=4OH- (注:在少数情况下,若周围介质的酸性较强,正极的反应是:2H++2e-=H2↑)
金属的腐蚀以电化腐蚀为主.例如,钢铁生锈的主要过程为
(1)吸氧腐蚀:金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀。
①发生条件:水膜的酸性很弱或呈中性
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
(2)析氢腐蚀:在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀。
①发生条件:水膜的酸性较强
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
钢铁的电化学腐蚀的两种类型:


金属腐蚀快慢的判断:
金属腐蚀的快慢与下列两个因素有关:
(1)与构成原电池的材料有关,两极材料的活泼性差别越大,电动势越大,氧化还原反应的速率越快,活泼金属被腐蚀的速率就越快。
(2)与金属所接触的电解质溶液的性质有关,活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。一般来说,可用下列原则判断:电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀>有防护措施的腐蚀
金属的化学腐蚀:
1、定义:金属跟接触到的干燥气体(如O2、Cl2、SO2 等)或非电解质液体 (如石油)等直接发生化学反应而引起的腐蚀
2、条件:金属跟氧化剂直接接触
3、现象:无电流产生
4、本质:金属被氧化而腐蚀
5、反应速率:v(电化学腐蚀)>v(化学腐蚀)
(1)外加电流的阴极保护法。如把金属连接在电源的负极上,这样就能消除引起金属腐蚀的原电池反应。
(2)牺牲阳极的阴极保护法。如在金属上铆接比它更活泼的另一种金属,发生金属腐蚀时是较活泼的金属被腐蚀而金属本身受到保护。
金属的表面防护:
(1)改变金属的组成或结构。如在铁中加入一定比例的铬炼制的铬钢,具有很强的耐腐蚀性。既含铬又含镍的铬镍不锈钢,其耐腐蚀性更好。
(2)在金属表面覆盖一层保护膜,使金属与周围具有腐蚀性的气体或电解质溶液隔离,便可保护金属,防止金属腐蚀。如在金属表面喷漆、电镀或表面钝化等。
与“下列有关说法正确的是( )A.铁制品镀层受损后,镀铜铁比镀...”考查相似的试题有:
- 化学反应N2+3H2===2NH3的能量变化如右图所示,该反应的热化学方程式是A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c)kJ·mol-B...
- 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。(1)已知在25 ℃、101 kPa时,C(s...
- 某同学在用锌与稀硫酸反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气生成的速率.请回答下列问题:(1)上述实验中...
- 某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图...
- 对于在一定条件下进行的化学反应:2SO2+ O2 2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是A.降低温度B.增大压...
- 于可逆反应,A2(g)+3B2(g)2AB3(g) △H
- 某研究性学习小组用如图装置研究不同能量之间的转化问题。下列说法正确的是( )A.断开开关S1,闭合开关S2,化学能转化为电能...
- 镀锌钢管具有广泛的用途,镀锌钢管有冷镀锌管和热镀锌管,冷镀即电镀,热镀是指熔融状态的锌与铁生成合金层。下列说法正确的...
- 某研究性学习小组设计了一个环保型消毒液发生器,如图所示装置,用一石墨作电极电解饱和NaCl溶液,请你完成以下实验探究过程...
- 下列事实不能用电化学理论解释的是( )A.镀锌铁比镀锡铁更耐用B.铝制品不需要采用特殊方法保护C.轮船吃水线以下的船壳上...