本试题 “已知可逆反应2SO2+O22SO3是放热反应,下列说法正确的是[ ]A.2molSO2与1molO2能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率B.2molSO2与1mol...” 主要考查您对吸热反应、放热反应
影响化学反应速率的因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 影响化学反应速率的因素
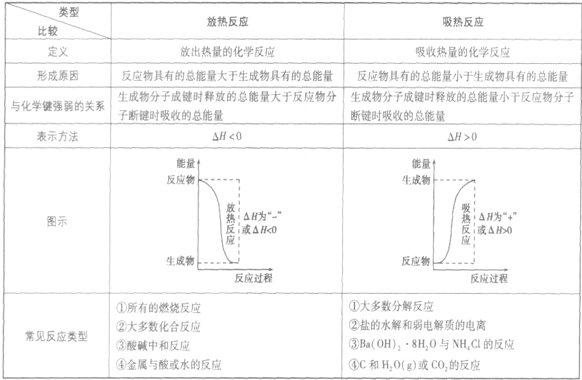
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
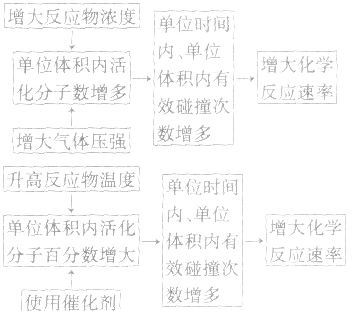
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为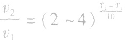
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
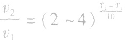
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

发现相似题
与“已知可逆反应2SO2+O22SO3是放热反应,下列说法正确的是[ ]A....”考查相似的试题有:
- 下列反应中,反应物总能量低于生成物总能量的是( )A.氨气合成B.酸碱中和反应C.氢氧化钡晶体和氯化铵反应D.铝与盐酸反应
- (12分)如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5 mL 盐酸于试管中.试...
- 一定混合气体在密闭容器中发生下列反应mA(g)+nB(g)pC(g)。平衡后,在一定温度下,将气体体积缩小到原来的1/2,当达到新平衡后...
- 下列图示与对应叙述相符的是A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化B.图②...
- 下列说法不正确的是( ) A.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 B.一定条件下,使用催化剂能加快反应速率...
- 反应:A(气)+3B(气)⇌2C(气)△H<0达平衡后,将气体混合物的温度降低.下列叙述中正确的是( )A.正反应速率加大,逆反...
- 在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为、。反应物A的浓度随时间的变化如下图所示。请回答下...
- 已知某反应在催化剂作用下按以下两步进行:第一步:X+Y=Z 第二步:Y+Z=M+N+X(1)此反应的总反应式为____________(2)反...
- 下列说法正确的是[ ]A.增大反应物浓度,可以增大单位体积内活化分子的百分数,从而使有效碰撞次数增多B.有气体参加的化学反应...
- 对达到平衡状态的可逆反应X+YZ+W,在其他条件不变的情况下,增大压强,反应速率变化如图所示,则图像中关于X、Y、Z、W四种物...