本试题 “某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5...” 主要考查您对影响化学反应速率的因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 影响化学反应速率的因素
影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为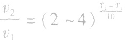
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
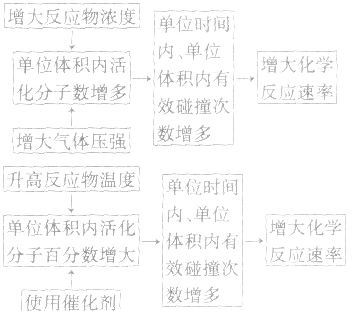
3.外因对化学反应速率影响的微观解释
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
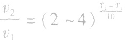
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

发现相似题
与“某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消...”考查相似的试题有:
- 100毫升12 摩/升盐酸溶液与过量锌粉反应,在一定温度下,为了减慢反应进行的速度,但又不影响生成氢气的总量,可向反应物中加...
- Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解...
- 用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答(1)实验过程如下图所示,分析判断:________段化学反应速率最快,____...
- 下列措施是为了降低化学反应速率的是( )A.把石灰石固体研细后与盐酸反应B.食品放在冰箱中贮藏C.用MnO2作H2O2分解反应的...
- Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol•L-1KMnO4溶液与2mL 0.1mol•L-1H2C2O4...
- 下列有关化学反应速率和限度的说法中,正确的是( )A.实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快B.实验室用H2O2...
- 在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨反应,根据下列在相同时间内测得的结果判断,该反应所处的温...
- 红矾钠(重铬酸钠:Na2Cr2O7-2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中...
- I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应②Fe(s)+H2O(g)FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2...
- NO和CO都是汽车尾气里的有害物质,有人提出通过以下反应来处理尾气:2NO(g ) + 2CO(g ) =N2(g ) + 2CO2(g )。 对上述反应,下...