本试题 “意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N-N吸收167 kJ热量,生成1mol NN放出942 kJ热量...” 主要考查您对极性键、非极性键
键能、键长、键角
化学键与化学反应中能量变化的关系
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 极性键、非极性键
- 键能、键长、键角
- 化学键与化学反应中能量变化的关系
极性键和非极性键:
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: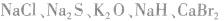 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: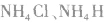 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(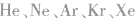 等)。
等)。
共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: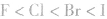
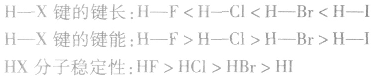
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
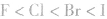
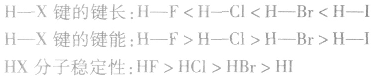
化学键与化学反应中能量变化的关系:
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。
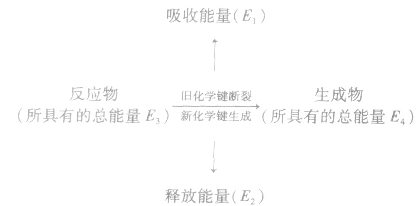
若 反应为放热反应;若
反应为放热反应;若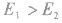 或
或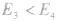 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若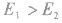 或
或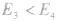 ,反应为吸热反应。
,反应为吸热反应。 发现相似题
与“意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的...”考查相似的试题有:
- 下列对一些实验事实的理论解释正确的是[ ]实验事实 理论解释A.SO2溶于水形成的溶液能导电SO2是电解质B.白磷为正四面体分子白...
- X、Y、Z、W四种元素,均位于元素周期表的前四周期,已知它们的核电荷数依次增大,且核电荷数之和为51;Y元素原子的L层p轨道中...
- 下列各组物质的晶体中,化学键类型相同,熔化时所克服的作用力也相同的是( )A.SO3和SiO2B.NaCl 和HClC.(NH4)2CO3和CH4D...
- 实验室用4molSO2与2molO2在一定条件下进行下列反应:2SO2(g)+O2(g)2SO3(g);△H=-197kJ/mol,当放出315.2kJ热量时,SO2...
- 下列不能形成配位键的组合是( )。A.Ag+、NH3B.H2O、H+C.Co3+、COD.Ag+、H+
- CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的顺序是( )。A.CH4、NH3、H2O、HFB.HF、H2O、NH3、CH4C.H2O、HF、CH4、...
- SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如下图所示,呈正八面体型。如果F元素有两种稳定的同位素,...
- 关于化学键的下列表述中,正确的是( )A.共价化合物可能含有离子键B.离子化合物中可能含有共价键C.离子化合物中只含有离...
- 下列有关化学键的叙述正确的是( )A.由两种元素组成的共价化合物分子中,只存在极性键B.不同种非金属元素原子间形成的化学...
- 下列各组物质汽化或熔化时,所克服的微粒间的作用力,属同种类型的是A.碘和干冰的升华B.二氧化硅和生石灰的熔化C.氯化钠和...