本试题 ““假说”在化学科学的研究和发展中起到不可替代的作用.下列“假说”在化学科学发展过程中曾经起到一定的作用,从目前的化学理论看,仍然科学的是( )A.道尔顿...” 主要考查您对原子核的组成及组成粒子间的关系
元素的性质
强电解质电离(氯化钠、硫酸氢钠等物质的电离)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
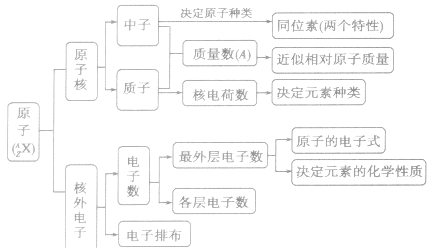
- 原子核的组成及组成粒子间的关系
- 元素的性质
- 强电解质电离(氯化钠、硫酸氢钠等物质的电离)
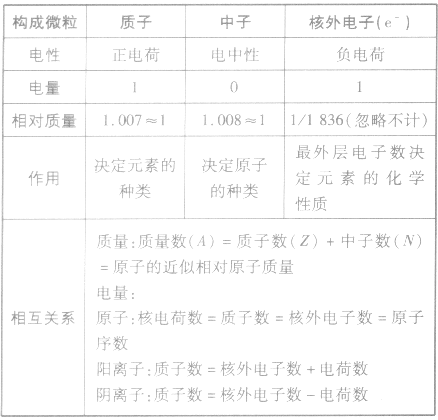
构成原子的三种微粒的比较:
原子的构成:
元素的性质:
由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。
碱金属元素的性质:
(1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强
(2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
(3)化合物性质
同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。
注: ①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。 ②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
(2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。
碱金属元素的性质:
(1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强
(2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
(3)化合物性质
同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。
注: ①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。 ②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2
 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。 (2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
强电解质电离:
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
酸与碱反应的几种情况:
1.等体积、等物质的量浓度的酸 混合
混合 
2.等体积的酸 混合
混合 
3.若酸 等体积混合溶液呈中性
等体积混合溶液呈中性 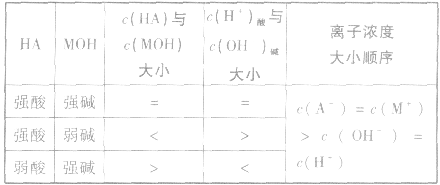
4.强酸溶液(pH=a)与强碱溶液(pH=b)完全中和时的体积比

发现相似题
与““假说”在化学科学的研究和发展中起到不可替代的作用.下列“假...”考查相似的试题有:
- 科学家最近制造出112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子,关于该新元素原子的下列叙述正确的是( ...
- 随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现.下列有关说法中正确的是( )A.N5+离...
- 元素周期表中,某短周期元素的原子核外最外层电子数比次外层电子数少5个,下列关于该元素的说法正确的是[ ]A.单质性质不活泼...
- 如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡一段时间后可见小球a 膨胀鼓起.下...
- 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等类型的化合物。(1)写出氯离子的离子结构示意图__________________...
- 下列有关物质的性质与应用相对应的是A.氢氟酸具有酸性,可用于雕刻玻璃B.Na2O2具有强氧化性,可用作呼吸面具的供氧剂C.氯...
- 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )选项陈述Ⅰ陈述ⅡA氧化性:Fe3+>Cu2+还原性:Fe2+>CuB纯银器表面在空气中渐渐变暗Ag...
- 类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论正确的是A.镁条在...
- 下列实验现象、结论及其推理都正确的是 ( )实验实验现象结论A左烧杯中铁不断溶解,右烧杯中铁表面有气泡活动性:Al>Fe>Cu...
- 下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )① NaHCO3; ② (NH4)2CO3; ③ Al2O3; ④ Al(OH)3; ⑤ AlA.全部...