本试题 “(14分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。阳离子H+、Na+、Al3+、Ag+、Ba2+阴离子OH-、Cl-、CO32-、NO3...” 主要考查您对强电解质、弱电解质
电解质、非电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强电解质、弱电解质
- 电解质、非电解质
强电解质:
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“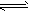 ”表示。
”表示。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
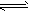 ”表示。
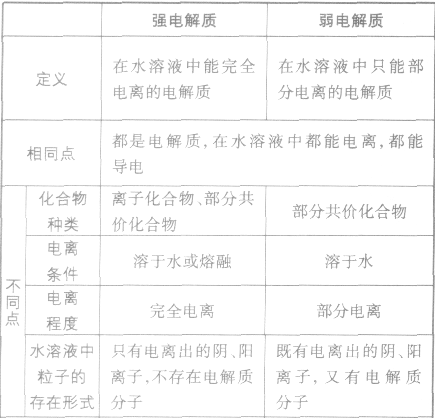
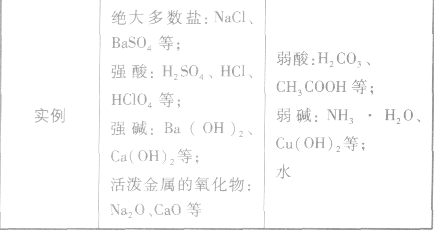
”表示。 强电解质和弱电解质的比较:
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如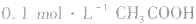 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
电解质和非电解质:
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
发现相似题
与“(14分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生...”考查相似的试题有:
- 在H2SO4和Al2(SO4)3的混合溶液中,铝离子浓度是0.4 mol / L,硫酸根离子浓度是0.7 mol / L,则氢离子浓度约是 ( )A.0.1 mo...
- 下列说法中,正确的是( )A.强电解质溶液的导电能力一定比弱电解质强B.相同温度下,0.1mol•L-1NH4Cl溶液中NH4+的浓度比0.1...
- (1)下列电解质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦Na2O;⑧K2O;⑨H2O, ______________是弱电解质。(2...
- 下列说法中正确的是( )A.强电解质溶液一定比弱电解质溶液的导电性强B.强电解质的水溶液中不存在溶质分子C.强电解质在熔...
- 下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )A.氯气B.醋酸钠C.碘化钾D.二氧化碳
- 下列选项中关于混合物、纯净物、电解质、非电解质的正确组合为[ ]纯净物 混合物电解质非电解质A.稀盐酸 水煤气硫酸干冰B.蒸馏...
- 下图的一些物质或概念间的从属关系中不正确的是[ ]X Y Z例 氧化物化合物 纯净物A.苯的同系物 芳香烃芳香族化合物B.胶体 分散...
- 下列四组物质中,前者属于非电解质,后者属于电解质的是( )A.氯化钠、碳酸钠B.氯化铜、二氧化硫C.蔗糖硫酸铜溶液D.乙醇...
- 下列物质中,属于电解质的是( )A.浓硫酸B.AlC.蔗糖D.HCl
- 七种物质回答问题:① 氢氧化钠固体 ② 铜丝 ③ 氯化氢气体 ④ 稀硫酸溶液 ⑤ 二氧化碳气体 ⑥ 蔗糖晶体 ⑦ 熔融氯化钠属于电...