本试题 “(15分)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1请回答下列问题:(1)取1 mol N2(g)...” 主要考查您对化学反应速率的定义、公式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应速率的定义、公式
化学反应速率:
1.定义:化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
2.表示方法:在容积不变的反应器中,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。即: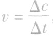
3.单位:mol·L-1·s-1或mol·L-1·min-1等。
4.注意:
(1)化学反应速率是指一段时间内的平均速率,而不是瞬时速率;通常前一段时间的平均反应速率要快于后一段时间的平均反应速率,反应速率均取正值,即v>0。
(2)在一定温度下,固体和纯液体物质单位体积的物质的量保持不变,即物质的量浓度为常数,因此在表示化学反应速率时,不代入固体或纯液体物质的浓度。浓度是指气体或溶液的浓度。
(3)同一个化学反应在相同的条件下、在同一段时间内,用不同物质表示反应速率时,数值可能相同也可能不同,但表达的意义都相同,即反应的快慢程度是一样的。
(4)在同一反应巾用不同的物质来表示反应速率时,其数值之比等于化学方程式中各物质的化学计量数之比.
如化学反应: ,
,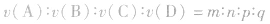 ,所以
,所以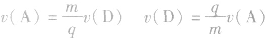
发现相似题
与“(15分)氮气和氢气合成氨是化学工业中极为重要的反应,其热化...”考查相似的试题有:
- 下列说法正确的是( )A.化学反应速率通常用单位时间内反应物或生成物的质量变化来表示B.用不同物质的浓度变化表示同一时间...
- 下列关于化学反应速率的说法错误的是[ ]A.化学反应速率是用于衡量化学反应进行快慢的物理量B.决定化学反应速率的主要因素是...
- 下列说法正确的是 ( )A.决定化学反应速率的主要因素是参加反应的物质的性质B.催化剂可以使不起反应的物质发生反应C.可以...
- 已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为...
- 工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)CH3OH(g).(1)图1是反应时CO和CH3OH(g)的浓度随时间变...
- 在一定条件下发生反应 2A(g)═2B(g)+C(g),将2mol A通入2L容积恒定的密闭容器甲中,若维持容器内温度不变,5min末测得A...
- 对于可逆反应M+N ≒ P + Q,有关说法正确的是A.四种物质的浓度相等,则一定达到了该反应的限度B.各物质的浓度不再发生变化时...
- 在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A + 3B == 2C 。反应经2min后,A的浓度从开始时的1.20mol·L-1下...
- 对反应A+BAB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol③0.1 mol·L-1的...
- 在2L的密闭容器中,充入1molSO2和1molO2,在一定条件下发生反应:2SO2+O22SO3,当反应进行了10s时,测得SO2的物质的量为0.6mo...