本试题 “(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子...” 主要考查您对化学反应速率的定义、公式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应速率的定义、公式
化学反应速率:
1.定义:化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
2.表示方法:在容积不变的反应器中,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。即: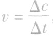
3.单位:mol·L-1·s-1或mol·L-1·min-1等。
4.注意:
(1)化学反应速率是指一段时间内的平均速率,而不是瞬时速率;通常前一段时间的平均反应速率要快于后一段时间的平均反应速率,反应速率均取正值,即v>0。
(2)在一定温度下,固体和纯液体物质单位体积的物质的量保持不变,即物质的量浓度为常数,因此在表示化学反应速率时,不代入固体或纯液体物质的浓度。浓度是指气体或溶液的浓度。
(3)同一个化学反应在相同的条件下、在同一段时间内,用不同物质表示反应速率时,数值可能相同也可能不同,但表达的意义都相同,即反应的快慢程度是一样的。
(4)在同一反应巾用不同的物质来表示反应速率时,其数值之比等于化学方程式中各物质的化学计量数之比.
如化学反应: ,
,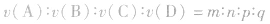 ,所以
,所以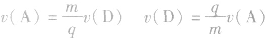
发现相似题
与“(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中...”考查相似的试题有:
- 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完...
- 化合物A由两种常见元素组成,且A中两种元素的质量比为4:1.A有如图所示转化关系,其中B、F均为红色固体,C能使品红溶液褪色...
- 反应AB+C,分别在甲、乙两个密闭容器中进行,甲中A物质每分钟减少4mol,乙中A物质每分钟减少2mol,则两容器中的反应速率A.甲...
- 铝与过量的稀盐酸反应,为了加快反应速率,同时几乎不影响生成的氢气总量,不可以采取的措施是A.加热,升高溶液温度B.加入...
- (14分)2SO2(g)+O2(g)2SO3(g)是生产硫酸的主要反应之一。下表是原料气按投料,在时,不同温度下SO2的平衡转化率。(1)该反...
- 反应4NH3+3O2→2N2+6H2O在5升的密闭容器中进行,半分钟后,N2的物质的量增加了0.6 摩,则此反应的平均速度vx(表示反应物的消...
- 对于化学反应:N2(g)+O2(g)2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。A.缩小...
- 一定条件下反应N2(g)+3H2(g) 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应...
- 可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),若反应速率分别用v(NH3),v(O2),v(NO),v(H2O)(mol•L-1•min-1)表示,则关...
- 反应A+3B==2C+D在某段时间内以A的浓度变化表示的反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率...