本试题 “氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%。工业上常通过下列反应制备CuCl:(1)CuCl制备过程中需...” 主要考查您对金属、非金属的有关计算
溶液质量分数的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 金属、非金属的有关计算
- 溶液质量分数的计算
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: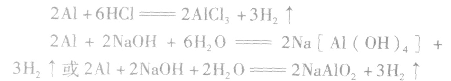
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为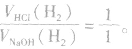
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为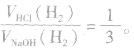
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为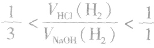 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: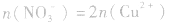
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
(1)溶质的质量分数=

(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:
①溶质的质量分数=
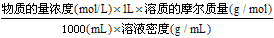
②物质的量浓度=

有关溶液密度的问题:
1.溶液质量分数与密度的关系
(1)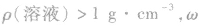 越大,则ρ(溶液)越大,常见溶液如NaCl溶液、硫酸溶液等。
越大,则ρ(溶液)越大,常见溶液如NaCl溶液、硫酸溶液等。
(2)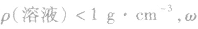 越大,则ρ(溶液)越小,常见溶液如氨水、酒精溶液等。
越大,则ρ(溶液)越小,常见溶液如氨水、酒精溶液等。
2.溶液混合后质量分数的变化规律
质量分数分别为 的两溶液(同种溶质)混合,混合后溶液的质量分数为ω。
的两溶液(同种溶质)混合,混合后溶液的质量分数为ω。
(1)等体积混合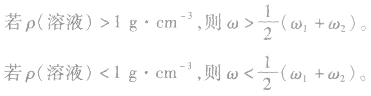
若是加等体积水稀释,可视 中其一为0 分析。
中其一为0 分析。
(2)等质量混合: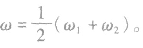
与“氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产...”考查相似的试题有:
- 某研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1g NaCl放入500 mL烧杯中,加入150 mL蒸馏水。待NaCl完全溶解...
- 一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体约为原总体积的[ ]A.1/4B.3/4C.1/8D.3/8
- 把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如图,则合金中镁和铝的质量比是[ ]A.1∶1B.8∶9C.4∶3...
- 将1.12 g铁粉加入25mL 2mol/L的FeCl3溶液中,充分发生2FeCl3+ Fe = 3FeCl2反应后,其结果是[ ]A.往溶液中滴入无色的KSCN溶...
- 化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。(1)从物质的分类角度来看,不恰当的一种物质...
- 有ag氧化铜和氧化铁的混合物,加入2 mol/L的硫酸溶液50 mL,恰好完全溶解,若将ag该混合物在过量 的CO气流中加热充分反应,冷...
- 将充满NO、NO2和O2混合气的烧瓶倒立于水中,瓶内液面逐渐上升,最后瓶内充满溶液,则原烧瓶中NO、NO2和O2的体积比不可能为[ ]...
- 等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在C的...
- 某铁的氧化物,用7mol/L的盐酸100mL在一定条件下恰好完全溶解,所得溶液再通入0.56L氯气时,刚好使溶液中Fe2+完全转化为Fe3+...
- 向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V ...