本试题 “恒容体系,发生如下反应2A(g)⇌B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实...” 主要考查您对化学反应的限度
化学平衡常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应的限度
- 化学平衡常数
化学反应的限度:
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)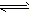 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: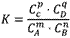
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
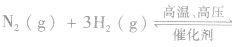


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
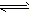 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: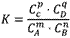
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
发现相似题
与“恒容体系,发生如下反应2A(g)⇌B(g)+xC(?)△H,起始时B...”考查相似的试题有:
- 将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)⇌C(g)+D(g),并达到平衡.C的体积...
- 向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下,发生下列反应:A(g)+B(g)⇌xC...
- 对于可逆反应:mA(s)+ nB(g)="==" eC(g)+ f D(g),反应过程中,不同温度(T1、T2)或不同压强(P1、P2)时,反应混合...
- 下列关于化学反应限度的叙述中正确的是( )A.化学反应的限度都相同B.可以通过改变反应条件控制化学反应的限度C.可以通过...
- 一定温度下,反应N2(g)+3H2(g)2NH3(g)达到化学平衡状态的标志是A.混合气体的总质量不再改变B.混合气体的平均相对分子质量不...
- 在密闭容器中,对于可逆反应2A+3 B 2C(g) 平衡时C的体积分数与温度和压强的关系如图所示,下列说法不正确的是
- 下列事实不能用勒夏特列原理解释的是A.打开啤酒瓶盖,产生大量气泡B.氢气与碘蒸气的平衡体系,加压后颜色加深C.制取乙酸丁...
- 硫酸是工业生产中最为重要的产品之一。在催化反应室里进行的反应为:2SO2(g)+O2(g)2SO3(g) ΔH= –196.6 kJ/mol(1)该反应发生...
- A+2B+H2OC+D当加水稀释时,平衡向_______(填“正”或“逆”)反应方向移动,理由是 。
- 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g) 为放热反应,400℃ 30 MPa下n(NH...