本试题 “氢离子浓度都为1×10-2mol/L的盐酸和醋酸各100 mL分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,有关叙述正确的是[ ]A. 醋酸与锌反应放出氢气...” 主要考查您对强酸和弱酸的比较
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强酸和弱酸的比较
强酸与弱酸(或强碱与弱碱)的比较:
1.强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质 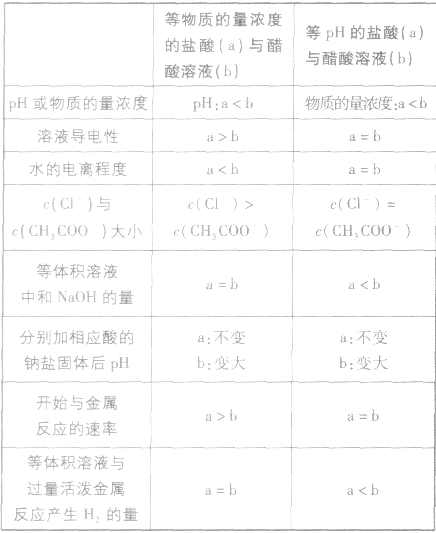
2.稀释时pH变化特点比较如下图:a、b分别为体积相等、pH相等的NaOH溶液和氨水的稀释曲线线;c、d分别为体积相等、pH相等的盐酸和醋酸溶液的稀释曲线,请体会图中的两层含义: 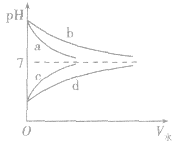
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸溶液。若稀释10n倍,盐酸、Na0H溶液pH变化n个单位,而氨水与醋酸溶液pH变化小到 n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水 >NaOH溶液,醋酸溶液>盐酸。
发现相似题
与“氢离子浓度都为1×10-2mol/L的盐酸和醋酸各100 mL分别稀释2倍...”考查相似的试题有:
- 列关于盐酸与醋酸两种稀溶液的说法正确的是[ ]A.相同浓度的两溶液中c(H+)相同B.100 mL 0.1 mol/L的两溶液能中和等物质的量...
- 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸。(用a、b、c、号填写)(1)当其物质的量浓度相同时,c(H+)由大到小的顺序...
- 氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相...
- pH相同的醋酸和盐酸,分别用蒸馏水稀释至原来体积的m倍和n倍。稀释后的溶液的pH仍相等,则m和n的关系是[ ]A.m>nB.m=nC.mD...
- 某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是[...
- 下列有关各溶液的表述正确的是[ ]A.0.1 mol·L-1NH4Cl溶液中:c(NH4+)=c(Cl-)B.将稀硫酸滴入硝酸钠溶液得到的pH=5的混合溶...
- 1mL pH值相同的醋酸和盐酸,分别用蒸馏水稀释到l00mL,稀释后两溶液的pH分别为m和n[ ]A.m>nB.m=nC.m<nD.不能确定
- 已知:①25℃时弱电解质电离平衡常数:Ka(CH3COOH) =1.8×10-5,Ka(HSCN) =0.13;难溶电解质的溶度积常数:Ksp(CaF2) =1. 5×10-1...
- 现有两正盐的稀溶液,分别是a mol·L-1NaX溶液和 b mol·L-1NaY溶液。下列说法不正确的是[ ]A.若a>b,测得c(X-)=c(Y-),可推出...
- 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:(1)不考虑其他组的实验结果...